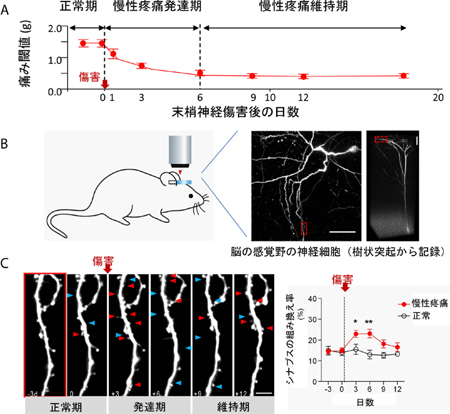
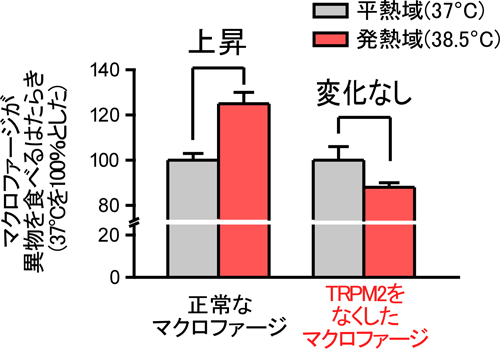
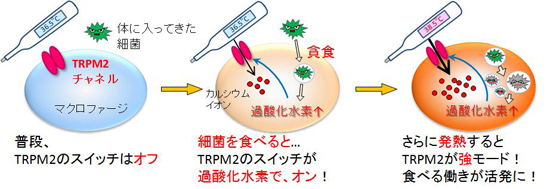
内容
再生医療の鍵を握るとして注目される幹細胞。すべての脳細胞の源となる神経幹細胞は、どのように出来るのでしょうか?今回、自然科学研究機構・生理学研究所の等 誠司(ひとし せいじ)准教授らの研究グループは、脳の全ての細胞の起源である神経幹細胞が生まれる際に、DNAの「脱メチル化」が起きることを世界で初めて示しました。ES細胞やiPS細胞を用いて神経細胞を作る際にも、この分子メカニズムが働いていると推定され、効率的な神経細胞の作製技術の進歩に期待できる研究成果です。英国科学誌のNature(ネーチャー)姉妹誌であるNature Neuroscience(米国・7月17日電子版)に掲載されます。
細胞が持つDNAには全ての遺伝子(ゲノム)情報が書き込まれていますが、細胞ごとの特徴に応じて必要な情報とそうでない情報が選り分けられて、不必要な情報は言わば「糊付け」によって隠されています。この「糊付け」を「DNAのメチル化」と呼んでいます。逆に必要な情報を取りだすためには、DNAの糊付けをはがす(メチル化を取り去るので「脱メチル化」と呼ぶ、図1)必要があります。等准教授の研究グループは今回、GCM(Glial cells missing)と呼ばれる遺伝子が働くと、この「DNAの脱メチル化」が起きることを世界で初めて証明しました(図2)。神経細胞が出来る前の胎児でGCM遺伝子が働くと、Hes5(ヘス・ファイブ)という別の遺伝子の「糊付け」がはがれ、Hes5遺伝子が活性化されます。そして、Hes5遺伝子が活性化することにより、脳の全ての細胞の起源である神経幹細胞が生まれることを解明しました。実際、GCM遺伝子がない遺伝子改変マウスでは、Hes5遺伝子が活性化されず、神経幹細胞が出来にくくなっていました(図3)。
等准教授は「神経細胞が生まれる際に、“脱メチル化”と呼ばれる分子メカニズムが関与していることを世界で初めて証明できた。ES細胞やiPS細胞を用いて神経細胞を生みだす際にも、この分子メカニズムは重要だと推定される。効率のよい神経細胞の作製技術の開発に役立てられるのでは」と語っています。
本研究は文部科学省科学研究費補助金の補助を受けて行われました。また、本研究は、東京大学・加藤茂明教授、理化学研究所・細谷俊彦チームリーダー、情報システム研究機構・堀田凱樹前機構長との共同研究の成果です。
今回の発見
1)全ての脳細胞の源である神経幹細胞が出来る際に、DNAの「脱メチル化」(DNAの「糊付け」を剥がす作用)が起きることを世界で初めて証明しました。
2)DNAの脱メチル化は、GCM(Glial cells missing)と呼ばれる遺伝子の働きによるものでした。
3)GCM遺伝子による脱メチル化作用で、Hes5(ヘス・ファイブ)という別の遺伝子の「糊付け」がはがれ、Hes5遺伝子が活性化されるようになり、効率よく神経幹細胞になることができることが分かりました。
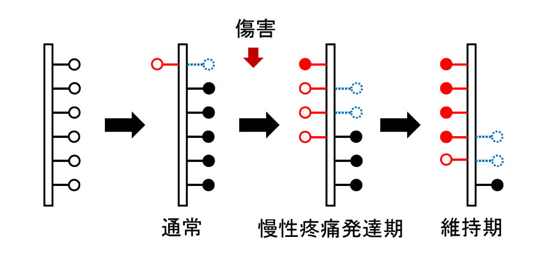
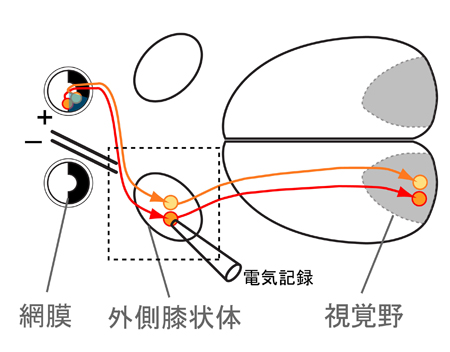
図1
全ての脳細胞の源、神経幹細胞を生みだす仕組み
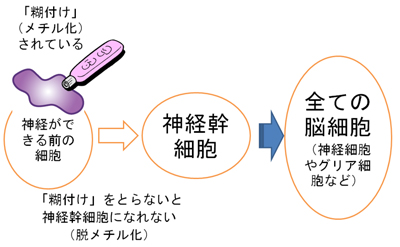
神経細胞やグリア細胞といった全ての脳細胞の源である神経幹細胞。今回の研究でこの神経幹細胞は、神経の出来る前の細胞のDNAの“糊づけ”を剥がすこと(脱メチル化)で効率よく生み出されることを明らかにしました。
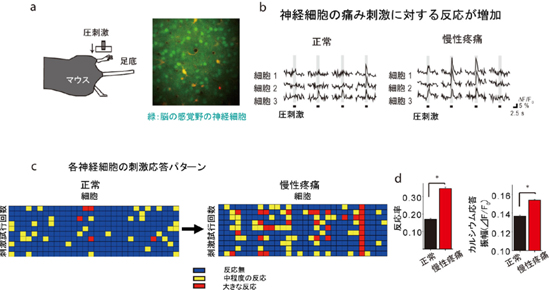
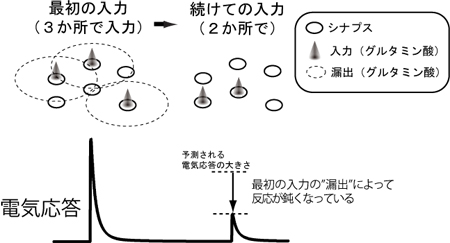
図2
DNAの“糊付け”をはぎ取る仕組み(脱メチル化)
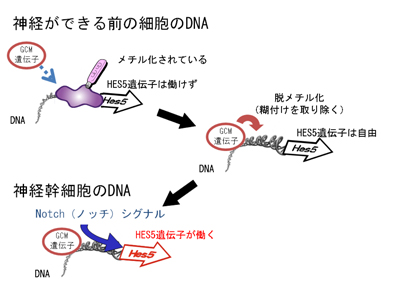
神経の出来る前の細胞のDNAでは、糊付けされてしまっている部分があり、神経幹細胞に重要なHes5遺伝子が上手く働くことができません。ここでGCM遺伝子が働くと、この糊付けを取り去ることができることがわかりました(脱メチル化)。これによって、幹細胞の細胞内信号として重要なNotch(ノッチ)シグナルの働きで、Hes5遺伝子が活性化することが可能となり、神経幹細胞として働くことができることが分かりました。
※ Notch(ノッチ)シグナル とは?
① 神経幹細胞に限らず、幹細胞の保持(自己複製能)に深くかかわっている細胞内の信号です。つまり、これによって、神経幹細胞が神経幹細胞でいられることができます。
② 幹細胞の自己複製能とは、幹細胞が様々な細胞に変化できる能力を保ったまま、動物の一生にわたって維持されることです。
③ たとえば、アルツハイマー病の治療薬として期待されているガンマセクレターゼ阻害剤も、ノッチシグナル活性を変化させます。
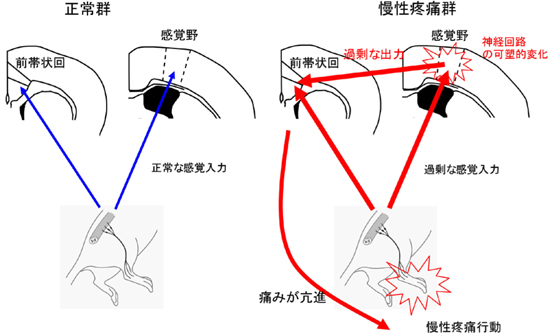
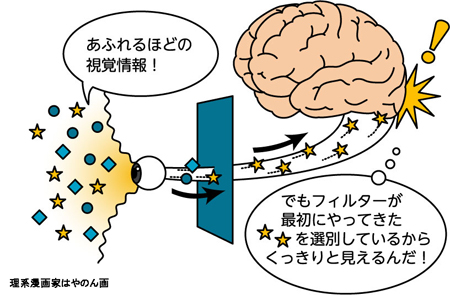
図3
GCM遺伝子がないと神経幹細胞が上手に作れない
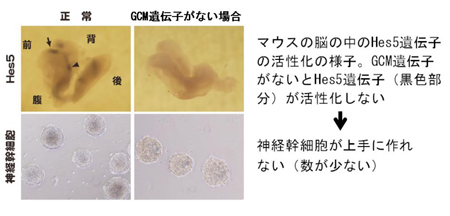
「脱メチル化」をすすめるGCM遺伝子がない遺伝子改変マウスでは、Hes5遺伝子が活性化できません(上図、右)。したがって、GCM遺伝子がない場合には、上手に神経幹細胞が作れないことがわかりました(下図、右、神経幹細胞の数が減っている)。
この研究の社会的意義
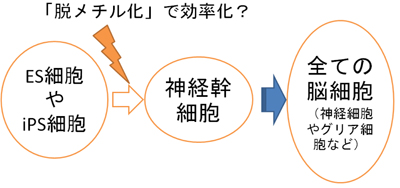
1.ES細胞やiPS細胞から効率よく神経幹細胞を作る技術の開発へ期待
ES細胞やiPS細胞といったあらゆる細胞になることができる多能性幹細胞から脳細胞が出来る際にも、全ての脳細胞の源となる神経幹細胞となることが知られています(図4)。今回の研究で、この際、DNAの「糊づけ」を剥がす「脱メチル化」が進むと、効率よく神経幹細胞ができることを初めて証明しました。今回の分子メカニズムを応用して、ES細胞やiPS細胞から効率よく神経幹細胞をつくり、神経細胞やグリア細胞などのあらゆる脳細胞を作り出すことができるものと期待されます。
論文情報
Mammalian glial cells missing genes induce Hes5 expression by active DNA demethylation and induce neural stem cell generation
Seiji Hitoshi,Yugo Ishino, Akhilesh Kumar, Salma Jasmine, Kenji F. Tanaka, Takeshi Kondo, Shigeaki Kato, Toshihiko Hosoya, Yoshiki Hotta, Kazuhiro Ikenaka
Nature Neurosciece 7月17日号(米国・電子版)
お問い合わせ先
<研究に関すること>
自然然科学研究機構 生理学研究所
准教授 等 誠司(ヒトシ セイジ)
Tel:0564-59-5246 Fax:0564-59-5247
E-mail:shitoshi@nips.ac.jp
<広報に関すること>
小泉 周 (コイズミ アマネ)
自然科学研究機構 生理学研究所 広報展開推進室 准教授
TEL 0564-55-7722、FAX 0564-55-7721
E-mail: pub-adm@nips.ac.jp





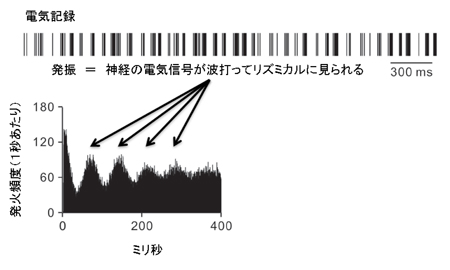
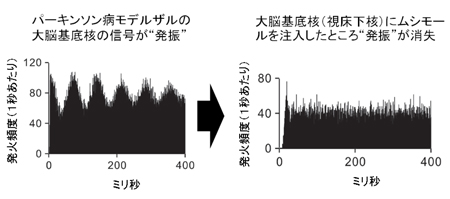
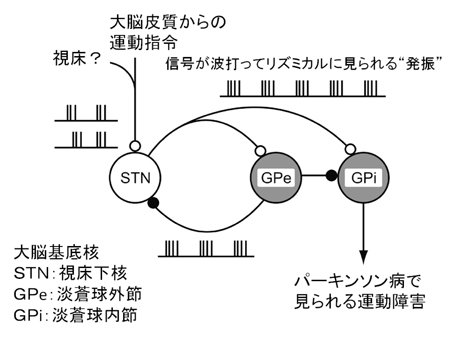
 写真:理科教材マッスルセンサー(マッスルセンサーは生理学研究所の登録商標です)。
写真:理科教材マッスルセンサー(マッスルセンサーは生理学研究所の登録商標です)。