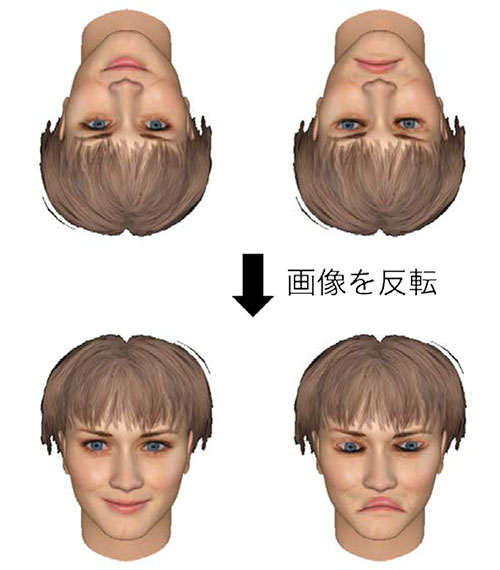
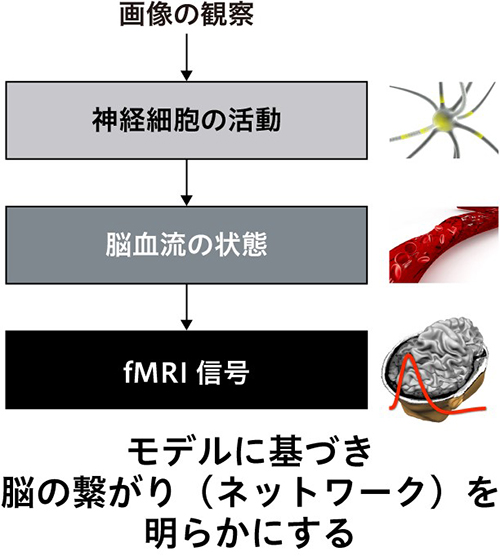
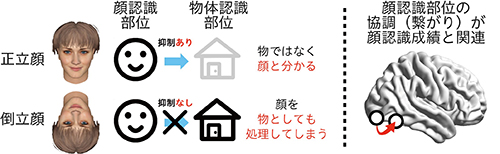
話題1 生理学研究所一般公開(10/4 開催)最終のご案内
“脳とからだのしくみ サイエンス・アドベンチャー”
特別企画、募集企画等についてのご説明
自然科学研究機構(岡崎)では、2014年10月4日(土曜日)に一般公開を開催いたします。今年は、生理学研究所の研究テーマである人体と脳の不思議をより身近に感じていただくために、「生理学研究所 一般公開 ―脳とからだのしくみ サイエンスアドベンチャー!―」をテーマに、生理学研究所のすべての研究室と研究内容を体験できる展示を中心に、様々な企画を考え、準備を進めております。
今回は、特別企画として、所内外の講師による、特別講演を予定いたしております。
所外からは、昨今、致死率の高い感染症が人間社会を脅かされる中、その一つでもある鳥インフルエンザについて、「鳥インフルエンザのパンデミックの可能性」と題し、東京大学医科学研究所 渡辺登喜子准教授に、続いて、南米チリに設置され、現在本格的な科学運用が開始されたアルマ望遠鏡の、国際アルマ望遠鏡計画に従事した、自然科学研究機構 国立天文台 井口聖教授には、「アルマ望遠鏡、ついに始動!―天文台の新時代の扉が開かれる―」と題して、それぞれご講演いただきます。
講演は、入場無料・予約不要ですので、この機会に、多くの市民の皆さまにいらしていただきたいと思っております。
また、楽しみながら「せいりけん」を知っていただけるように、「せいりけんスタンプラリー」をご用意しています。多くの研究室を巡って、5つのスタンプを見つけ、せいりけんグッズを手に入れてください。
![2014ippannkoukaiPoster.jpg]()
日時:2014年10月4日 土曜日9:30-17:00 (受付終了 16:00)
場所:第1会場:生理学研究所明大寺キャンパス
(名鉄東岡 崎駅南口より徒歩10分)
第2会場:岡崎コンファレンスセンター
(名鉄東岡崎駅南口より名鉄バス
竜美丘循環岡崎高校前下車徒歩2分)
※国立大学フェスタ2014の一環として行われます。
![2014daigakuFestaLogo.jpg]()
一般公開の詳細については、生理研一般公開特設HPをご覧ください
http://www.nips.ac.jp/open
<特別企画>特別企画(どなたでも参加いただけます。 予約不要です)
特別講演① 10:00~10:45 岡崎コンファレンスセンター
箕越 靖彦 先生(自然科学研究機構 生理学研究所 生殖・内分泌系発達機構研究部門 教授)
「体の恒常性を司る脳 — 肥満とやせの不思議を探る」
座長 鍋倉 淳一 (生理学研究所 教授)
【内容】
近年、世界中で肥満が問題となっています。しかしながら、個人差や年齢の影響は大きいものの、少しぐらい暴飲暴食をしても多くの人があ まり太らないことも事実です。ご飯一杯分を毎日余分に食べると、私達の体は10キロ近く太るはずですが、そんなに太ることはまれです。反対に、食事が摂れ ない時には痩せすぎないよう、体を調節しています。近年の研究により、これらの調節に脳が重要であることが明らかとなってきました。また、生活習慣によっ て脳に変化が起こり、肥満することも分かってきました。本講演では、肥満とやせに関わる体の不思議についてお話します。
|
箕越 靖彦 氏 愛媛大学医学部卒、愛媛大学大学院医学研究科博士課程修了。医学博士。同大学医学部助手、講師、助教授、ハーバード大学医学部Lecturerを経て、2003年11月より現職。
|
特別講演② 11:00~11:45 岡崎コンファレンスセンター
定藤 規弘 先生(自然科学研究機構 生理学研究所 心理生理学研究部門 教授)
「褒め を科学する」
座長 小松 英彦(生理学研究所 教授)
【内容】
褒めは他者による肯定的な評価のことで、社会的承認と捉えることができ、人間が無事に生きていくための重要な条件の一つです。近年急速 な発展を遂げた人間の高次脳機能計測手法により、社会的承認(褒め)は、基本的報酬や金銭報酬と共通の神経基盤をもつことが明らかになりました。今後重要 性を増すと考えられる脳科学的知見と教育研究の関係について解説します。
![sadatou.jpg]()
|
定藤 規弘 氏 京都大学医学部卒、同大学院修了、医学博士。米国NIH客員研究員、福井医科大学高エネルギー医学研究センター講師、助教授を経て1999年1月より現職。専攻は医療画像、神経科学。
|
特別講演③ 13:00~13:45 岡崎コンファレンスセンター
渡辺 登喜子 先生(東京大学東京大学医科学研究所 感染・免疫部門 ウイルス感染分野 特任准教授)
「鳥インフルエンザウイルスパンデミックの可能性」
座長 岡本 秀彦(生理学研究所 准教授)
【内容】
ここ数十年の間に、エイズ、エボラ出血熱、SARSといった致死率の高い感染症が人間社会に現れており、多くの犠牲者を出しています。 その一つである“鳥インフルエンザ”は、鳥類に感染する鳥インフルエンザウイルスがヒトに感染して重篤な症状を起こす感染症です。一般的に、鳥インフルエ ンザウイルスはヒトに感染しにくいと言われています。しかし、近年、H5N1亜型やH7N9亜型の鳥インフルエンザウイルスのヒトへの感染例が増加してお り、公衆衛生上、深刻な問題となっています。今までのところ、ヒトーヒト間の伝播は見られていませんが、もしもこれらのウイルスがヒトに適応し、ヒトへの 感染やヒトーヒト間での伝播が効率よく起こるようになれば、鳥インフルエンザウイルスによるパンデミックが引き起こされ、世界はパニックに陥ると考えられ ます。
本講演では、最近得られた研究結果を元に、鳥インフルエンザウイルスのパンデミックの可能性について論じます。
|
渡辺 登喜子 氏 北 海道大学大学院大学獣医学研究科博士課程修了(獣医学博士)。米国ウイスコンシン大学インフルエンザリサーチ研究 所にてAssistant Scientistを経験後、科学技術振興機構ERATO河岡感染宿主応答ネットワークプロジェクトのグループリーダーに就任。現在は東京大学医科学研究 所 感染免疫部門ウイルス感染分野の特任准教授。 |
特別講演④ 14:00~15:15 岡崎コンファレンスセンター
井口 聖 先生(自然科学研究機構 国立天文台 電波研究部 教授)
「アルマ望遠鏡、ついに始動! -天文学の新時代の扉が開かれる-」
座長 南部 篤(生理学研究所 教授)
【内容】
日米欧共同で建設したアルマ望遠鏡。南米のチリ共和国、アンデス山中にあるアタカマ砂漠、標高5000mのチャナントール高原に設置さ れた究極のミリ波サブミリ波電波望遠鏡は、世界中の多くの天文学者の期待を背に、2011年9月より初期科学運用が開始し、2013年3月には現地にて開 所式典が挙行されました。現在本格的な科学運用が行われ、日々性能向上にも努めながら、さまざまな観測成果が発表されています。本講演では、アルマ望遠鏡 が解き明かしてくれるであろう「これまでの謎」そして「新しい天文学への展開」について紹介します。また、66台のアンテナを1つに結合させる電波干渉 計、この根幹となる「開口合成法」についても紹介します。
|
井口 聖 氏 学 位授与後、国立天文台に就職し、2012年より国立天文台・総合研究大学院大学・教授。国際アルマ望遠鏡計画に従事 し、2008年より、アルマ東アジア・プロジェクトマネージャとして計画を推進。2008年度日本天文学会研究奨励賞・受賞、平成25年度・科学技術分野 の文部科学大臣表彰・科学技術賞・研究部門・受賞。 |
研究室公開
開催場所ご案内
明大寺キャンパス
| 展示テーマ | 備考欄 |
| 脳の分子の働きをカエルの卵で調べる | |
| 肥満の不思議を科学する | |
| 超高圧電子顕微鏡の見学とスマホ顕微鏡の体験実験 | 観察 |
| 視覚と運動を支える脳内メカニズム | 体験! |
脳の細胞たちを撮ってみよう
~蛍光タンパク質で脳を光らせる~ | 体験!
観察 |
明大寺会議室
| 展示テーマ | 備考欄 |
| 脳波を使ったうそ発見器の実演 | 体験! |
| 人の『こころ』を見る ~fMRI研究~ | |
| 自分の心臓、血流の音を聞いてみよう! | 体験! |
| 体感しよう、運動学習 | 体験! |
脳がみている世界
~あなたが見ている世界は本物か?~ | 体験!
観察 |
遺伝子・脳・行動
―遺伝子改変マウスを用いた研究― | |
| 生理学実験の技術開発と公開 | |
| 君は何を見ているのか? | 体験! |
| ウイルスベクターって何だろう? | 体験! |
岡崎コンファレンスセンター
| 展示テーマ | 備考欄 |
| 細胞を部品に分けてみよう | 体験! |
顕微鏡で見る脳の神経細胞
のぞいてみよう!不思議なかたち | 観察 |
「温度」「におい」ってどうやって感じるの?
においと温度の意外なっ関係 | 体験! |
感じ方・考え方・覚え方のしくみ:
神経細胞の働きから解き明かす | 体験! |
| 色がついた脳細胞を観察してみよう | 観察 |
生殖医療を支える発生工学技術
―ネズミの体外受精やiPS細胞をみてみよう― | |
ドキドキ体験!!
♡見てみよう動く心臓♡ | |
ひらめきときめきサイエンス マッスルセンサー工作体験教室 (要予約)
「脳の中で神経の電気信号はどうやって伝わっていくか調べてみよう!
カラダの電気信号でロボットアームを動かす!!」
![hiratokiLogo.jpg]()
開催日:2014年10月4日(土) ※申し込み締め切りは9/8 17:00
時 間: 中学生 10時受付 高校生 14時受付
会 場:一般公開 明大寺会場 生理学研究所 広報展示室
共 催:日本学術振興会
【お問い合わせ先】自然科学研究機構 生理学研究所技術課
☆アンケートに答えて生理研オリジナルノートブックをもらおう!
![noteimage.gif]()
生理研公式キャラクター のう君
![stamprally.jpg]()
☆5つのスタンプ集めてね!生理研オリジナルのすてきなお土産をプレゼント
話題2 生理研が豪州New South Wales大学(UNSW)医学部との学術協定に調印。
8月14日に井本所長と鍋倉副所長が、生理研とUNSW医学部間の学術協定調印のため豪州を訪問し、協定書に双方が署名しました。UNSWはシドニーにある学生数約5万人の国立大学で、オーストラリアTop 5の一つです。UNSWの生理学・神経科学の規模はそれほど大きくありませんが、オーストラリアの伝統として電気生理をはじめとする計測技術を得意とし、特に人工内耳の基礎研究が盛んに行われています。
生理研とUNSWの研究交流が、両研究所にとってこれまでにない新しい研究アプローチをもたらし、素晴らしい発見への礎となることが期待されます。
![Group photo_50%.jpg]()
![20140814NIPS_UNSW.jpg]()

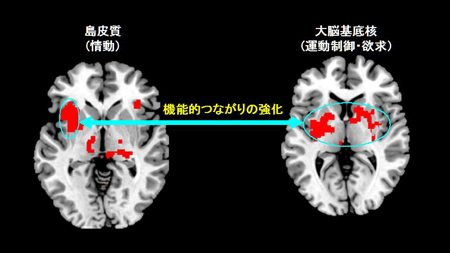

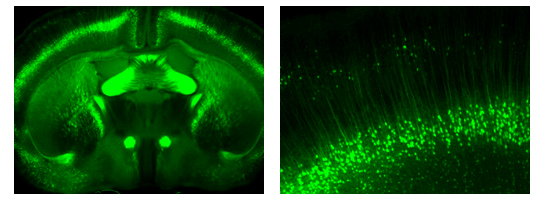

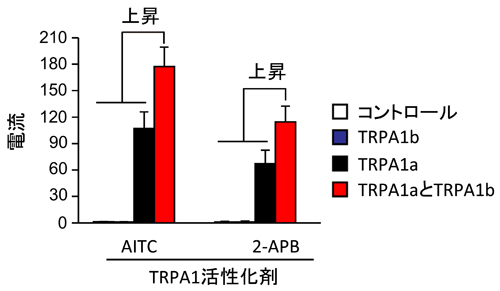 普通のワサビ受容体(TRPA1a)とTRPA1のスプライスバリアント(TRPA1b)をもった培養細胞の2種類のTRPA1活性化剤に対する反応。TRPA1bだけをもった細胞ではTRPA1の応答は見られませんでした。TRPA1aとTRPA1bの両方をもった細胞では、TRPA1aだけをもった細胞より大きな電流応答が観察されました。TRPA1aとTRPA1bの両方があることによってTRPA1機能が増強することがわかりました。これは、痛みが強くなることにつながると考えられます。
普通のワサビ受容体(TRPA1a)とTRPA1のスプライスバリアント(TRPA1b)をもった培養細胞の2種類のTRPA1活性化剤に対する反応。TRPA1bだけをもった細胞ではTRPA1の応答は見られませんでした。TRPA1aとTRPA1bの両方をもった細胞では、TRPA1aだけをもった細胞より大きな電流応答が観察されました。TRPA1aとTRPA1bの両方があることによってTRPA1機能が増強することがわかりました。これは、痛みが強くなることにつながると考えられます。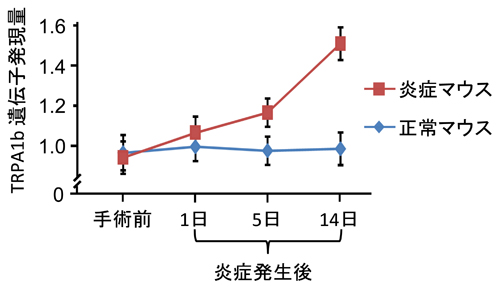 正常マウスではTRPA1b遺伝子(mRNA)は14日まで変化しませんが、CFA(シーエフエー)という起炎物質を足底に注射した炎症性疼痛モデルマウスでは、TRPA1b mRNA量がどんどん増えていくのがわかります。神経障害性モデルでも同様の現象が認められました。
正常マウスではTRPA1b遺伝子(mRNA)は14日まで変化しませんが、CFA(シーエフエー)という起炎物質を足底に注射した炎症性疼痛モデルマウスでは、TRPA1b mRNA量がどんどん増えていくのがわかります。神経障害性モデルでも同様の現象が認められました。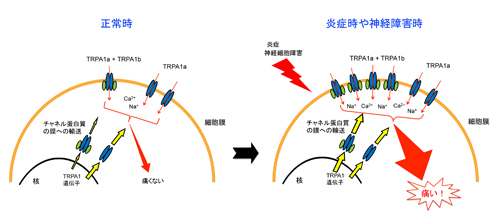 炎症時や神経障害時にはTRPA1bが増えて、感覚神経細胞膜上のTRPA1a/TRPA1b複合体量が増加します。そして、TRPA1の応答性が増強して大きな電流が流れることによって痛み増強につながると考えられます。
炎症時や神経障害時にはTRPA1bが増えて、感覚神経細胞膜上のTRPA1a/TRPA1b複合体量が増加します。そして、TRPA1の応答性が増強して大きな電流が流れることによって痛み増強につながると考えられます。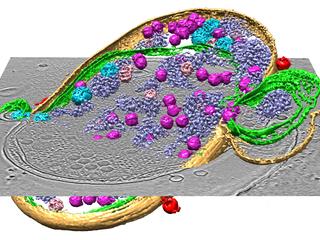 急速凍結法により氷に閉じ込められたシアノバクテリアについて、位相差電子顕微鏡より内部のウイルスを含めたシアノバクテリアの微細立体構造が明らかとなった。(ベイラー医科大のホームページより)
急速凍結法により氷に閉じ込められたシアノバクテリアについて、位相差電子顕微鏡より内部のウイルスを含めたシアノバクテリアの微細立体構造が明らかとなった。(ベイラー医科大のホームページより)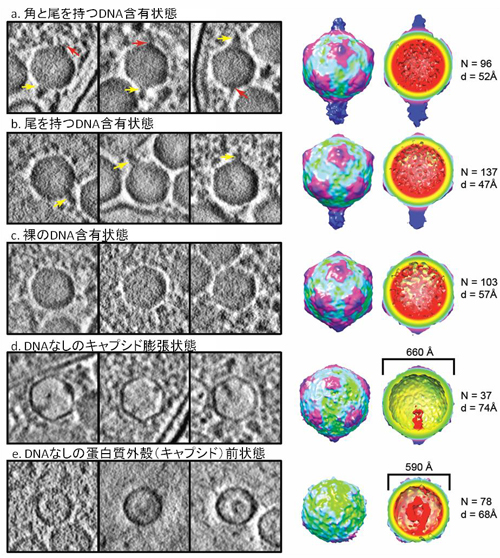
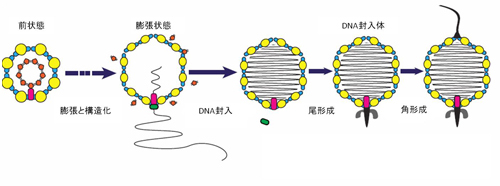

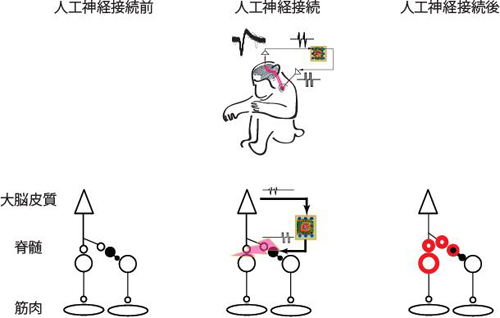
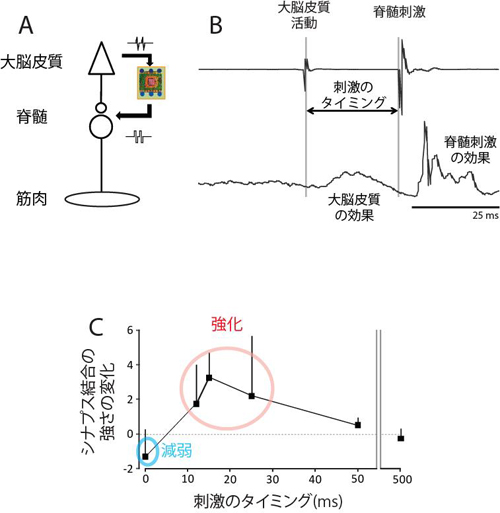

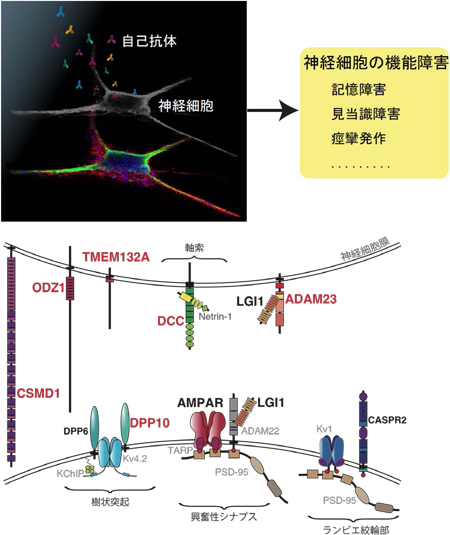 自己抗体は文字通り自己の蛋白質に対して反応し、細胞、組織、臓器に障害を引き起こします。今回、研究グループは脳神経細胞の蛋白質に対する既知の自己抗体(黒字の蛋白質に対する抗体)に加えて、さまざまな蛋白質に対する新規の自己抗体(赤字の蛋白質に対する抗体)を発見しました。
自己抗体は文字通り自己の蛋白質に対して反応し、細胞、組織、臓器に障害を引き起こします。今回、研究グループは脳神経細胞の蛋白質に対する既知の自己抗体(黒字の蛋白質に対する抗体)に加えて、さまざまな蛋白質に対する新規の自己抗体(赤字の蛋白質に対する抗体)を発見しました。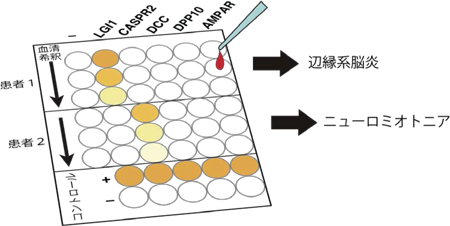 今回、多数の新規自己抗体の標的抗原を同定したことにより、一人の患者血清中にどのタイプの抗体がどの程度存在しているかを簡便、高感度、かつ特異的に測定することが可能となりました。
今回、多数の新規自己抗体の標的抗原を同定したことにより、一人の患者血清中にどのタイプの抗体がどの程度存在しているかを簡便、高感度、かつ特異的に測定することが可能となりました。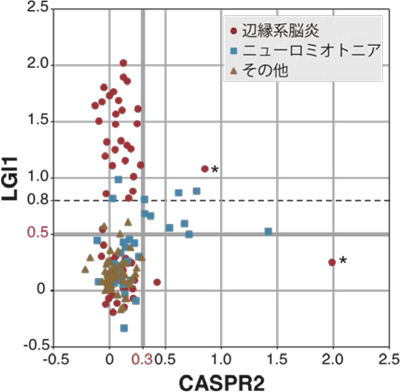 LGI1抗体価(縦軸)とCASPR2抗体価(横軸)と疾患との関連性を示しています。LGI1抗体価が0.8以上の患者さんは殆ど例外なく辺縁系脳炎と診断されていたことが明らかになりました(左上の赤色の群)。一方、CASPR2抗体価が0.3以上の患者さんはニューロミオトニア(神経筋緊張病)のケースが有意に多いことが分かりました(右中央の青色の群)。
LGI1抗体価(縦軸)とCASPR2抗体価(横軸)と疾患との関連性を示しています。LGI1抗体価が0.8以上の患者さんは殆ど例外なく辺縁系脳炎と診断されていたことが明らかになりました(左上の赤色の群)。一方、CASPR2抗体価が0.3以上の患者さんはニューロミオトニア(神経筋緊張病)のケースが有意に多いことが分かりました(右中央の青色の群)。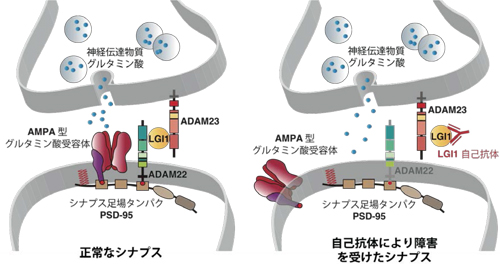 通常、LGI1はシナプス間隙でADAM22、ADAM23と結合し、AMPA型グルタミン酸受容体を精緻にコントロールしています。一方、LGI1の機能が自己抗体により後天的に阻害されると、シナプスにおけるAMPA型グルタミン酸受容体機能が低下し無秩序なシナプス伝達が生じます。その結果、痙攣発作を伴うてんかん病態や記憶障害が生じると考えられます。
通常、LGI1はシナプス間隙でADAM22、ADAM23と結合し、AMPA型グルタミン酸受容体を精緻にコントロールしています。一方、LGI1の機能が自己抗体により後天的に阻害されると、シナプスにおけるAMPA型グルタミン酸受容体機能が低下し無秩序なシナプス伝達が生じます。その結果、痙攣発作を伴うてんかん病態や記憶障害が生じると考えられます。
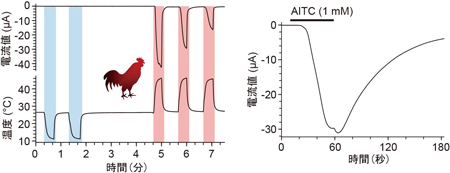 マウスのTRPA1は低温に反応すると報告されていますが、ニワトリTRPA1は低温刺激には反応せず、高温刺激を与えた場合にのみ明瞭な電流応答が生じました。また、ワサビの辛み成分であるアリルイソチオシアネート(AITC)にも反応しました。ニワトリではTRPA1は高温と刺激性化学物質のセンサーとして機能することを示しています。
マウスのTRPA1は低温に反応すると報告されていますが、ニワトリTRPA1は低温刺激には反応せず、高温刺激を与えた場合にのみ明瞭な電流応答が生じました。また、ワサビの辛み成分であるアリルイソチオシアネート(AITC)にも反応しました。ニワトリではTRPA1は高温と刺激性化学物質のセンサーとして機能することを示しています。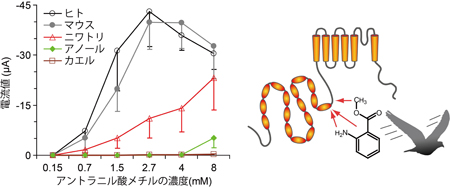 アントラニル酸メチルに対するTRPA1の活性を5種の脊椎動物種間で比較したところ、ニワトリ、マウス、ヒトのTRPA1では明瞭な反応が観察されるのに対して、ニシツメガエルとグリーンアノールトカゲのTRPA1では反応が小さかった。また、ニワトリTRPA1のアントラニル酸メチルによる活性化には互いに近接した3つのアミノ酸が重要な役割を担うことが分かった。
アントラニル酸メチルに対するTRPA1の活性を5種の脊椎動物種間で比較したところ、ニワトリ、マウス、ヒトのTRPA1では明瞭な反応が観察されるのに対して、ニシツメガエルとグリーンアノールトカゲのTRPA1では反応が小さかった。また、ニワトリTRPA1のアントラニル酸メチルによる活性化には互いに近接した3つのアミノ酸が重要な役割を担うことが分かった。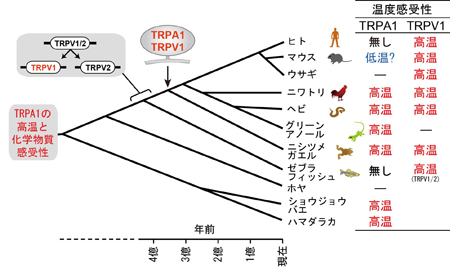 高温センサーであるニワトリのTRPA1は、同じ恒温動物である哺乳類とは特性が異なり、むしろ、変温動物である両生類や爬虫類のTRPA1と類似していました。脊椎動物はもう一つの高温センサーとしてTRPV1を維持しているために、動物種によってはTRPA1の温度感受性が変化したと考えられます。一方、体にダメージを与え得る刺激を感じる能力はどの動物種にも必須であるため、いずれの動物種もTRPA1の化学物質感受性を維持してきたと考えられます。
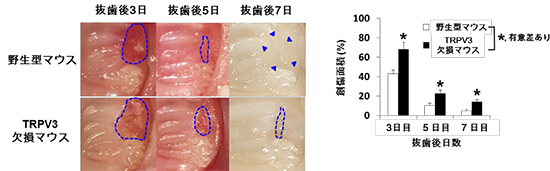
高温センサーであるニワトリのTRPA1は、同じ恒温動物である哺乳類とは特性が異なり、むしろ、変温動物である両生類や爬虫類のTRPA1と類似していました。脊椎動物はもう一つの高温センサーとしてTRPV1を維持しているために、動物種によってはTRPA1の温度感受性が変化したと考えられます。一方、体にダメージを与え得る刺激を感じる能力はどの動物種にも必須であるため、いずれの動物種もTRPA1の化学物質感受性を維持してきたと考えられます。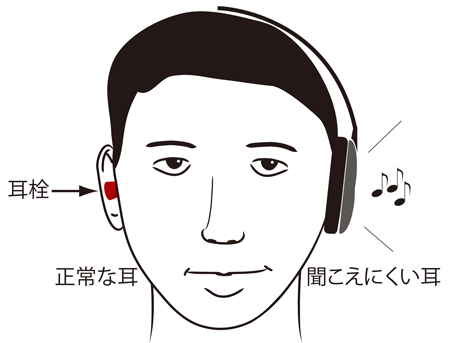 突発性難聴の患者さんの正常な耳には耳栓をします。耳栓は入院中ずっとしてもらいます。そして聞こえにくい方の耳で入院中毎日6時間ヘッドホンから音楽を聞いてもらいます。
突発性難聴の患者さんの正常な耳には耳栓をします。耳栓は入院中ずっとしてもらいます。そして聞こえにくい方の耳で入院中毎日6時間ヘッドホンから音楽を聞いてもらいます。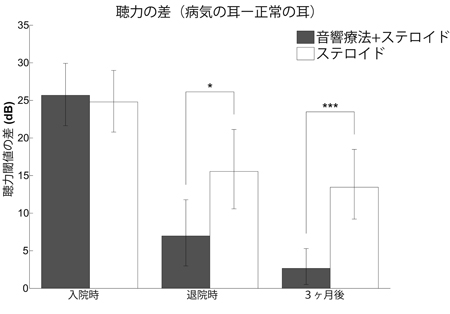 突発性難聴発症後の聴力を比較した。通常行われるステロイド療法にリハビリテーション療法を加えた患者群(灰色の棒グラフ)の方が、ステロイド療法単独の患者群(白色の棒グラフ)よりも聴力の回復が良かった(この図では棒グラフの値が0に近づくほど聴力が回復していることを示しています)。
突発性難聴発症後の聴力を比較した。通常行われるステロイド療法にリハビリテーション療法を加えた患者群(灰色の棒グラフ)の方が、ステロイド療法単独の患者群(白色の棒グラフ)よりも聴力の回復が良かった(この図では棒グラフの値が0に近づくほど聴力が回復していることを示しています)。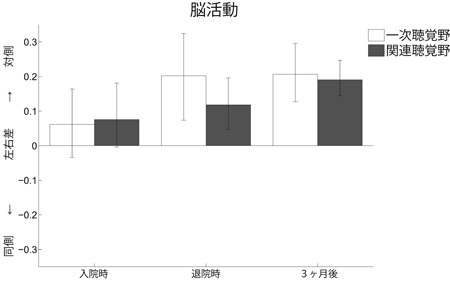 リハビリテーション療法(音響療法)を行った患者に片耳から音を聞かせた時の脳活動を調べました。聴力低下の無い健常者では対側の脳の神経活動がやや大きいのですが(左右差=約0.2)、突発性難聴発症時には脳神経活動にあまり左右差を認めませんでした。しかしながら、ステロイド+音響療法を行うと発症後約3ヶ月で、聴力低下の無い健常者の脳活動の左右差とほぼ同等になりました。
リハビリテーション療法(音響療法)を行った患者に片耳から音を聞かせた時の脳活動を調べました。聴力低下の無い健常者では対側の脳の神経活動がやや大きいのですが(左右差=約0.2)、突発性難聴発症時には脳神経活動にあまり左右差を認めませんでした。しかしながら、ステロイド+音響療法を行うと発症後約3ヶ月で、聴力低下の無い健常者の脳活動の左右差とほぼ同等になりました。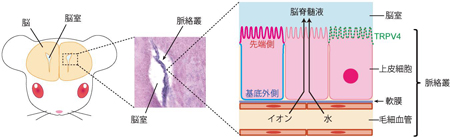 3つある脳室(側脳室、第3脳室、第4脳室)のすべての領域において脈絡叢(濃い紫の部分)は存在しています。脈絡叢は上皮細胞、軟膜、毛細血管から成る一層構造でTRPV4は上皮細胞の先端側に多く存在しています。上皮細胞ではトランスポーターやイオンチャネルにより絶えずイオンが血管側から脳室側へと輸送されているため、それに伴う水の移動が起こり、結果として脳脊髄液が脈絡叢から分泌されています。
3つある脳室(側脳室、第3脳室、第4脳室)のすべての領域において脈絡叢(濃い紫の部分)は存在しています。脈絡叢は上皮細胞、軟膜、毛細血管から成る一層構造でTRPV4は上皮細胞の先端側に多く存在しています。上皮細胞ではトランスポーターやイオンチャネルにより絶えずイオンが血管側から脳室側へと輸送されているため、それに伴う水の移動が起こり、結果として脳脊髄液が脈絡叢から分泌されています。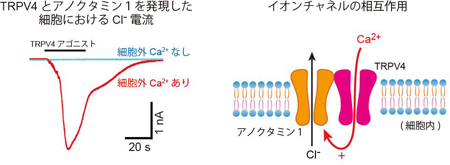 TRPV4とアノクタミン1を共発現している細胞においてホールセルパッチクランプ法により観察されたクロライド電流。共発現細胞では、TRPV4アゴニストによって大きな電流が観察されます(左)。また、この電流は細胞外カルシウムを除去した状態では観察されないことから、TRPV4活性によるカルシウムの細胞内への流入がアノクタミン1を活性化させることが示されました(右)。
TRPV4とアノクタミン1を共発現している細胞においてホールセルパッチクランプ法により観察されたクロライド電流。共発現細胞では、TRPV4アゴニストによって大きな電流が観察されます(左)。また、この電流は細胞外カルシウムを除去した状態では観察されないことから、TRPV4活性によるカルシウムの細胞内への流入がアノクタミン1を活性化させることが示されました(右)。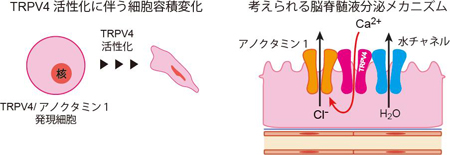 TRPV4とアノクタミン1を発現した細胞においてTRPV4活性化に伴い観察される細胞収縮のモデル図(左)。脈絡叢上皮細胞においてTRPV4が活性化するとTRPV4-アノクタミン1相互作用によりクロライドが流出し、TRPV4と結合する水チャネルを介して水流出も促進されると考えられます(右)。
TRPV4とアノクタミン1を発現した細胞においてTRPV4活性化に伴い観察される細胞収縮のモデル図(左)。脈絡叢上皮細胞においてTRPV4が活性化するとTRPV4-アノクタミン1相互作用によりクロライドが流出し、TRPV4と結合する水チャネルを介して水流出も促進されると考えられます(右)。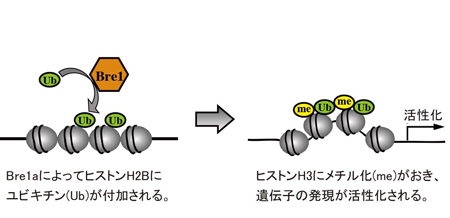 Bre1aは、DNAが巻き付いているヒストンと呼ばれるタンパク質の1つ、H2Bにユビキチンと呼ばれるタンパク質を付加します。その反応が引き金になり、隣のヒストンH3がメチル化され、近傍の遺伝子の発現が活性化されます。
Bre1aは、DNAが巻き付いているヒストンと呼ばれるタンパク質の1つ、H2Bにユビキチンと呼ばれるタンパク質を付加します。その反応が引き金になり、隣のヒストンH3がメチル化され、近傍の遺伝子の発現が活性化されます。

 解説
解説
 心臓では複数種類のイオンチャネルがさまざまなタイミングで開閉して心臓の活動電位を制御しています。その中でも、KCNQ1/KCNE1チャネルによるIKs電流は活動電位の比較的遅いタイミングで流れます。遺伝子の異常などによりIKs電流がなくなってしまうと、活動電位の延長が起き(赤い点線)、QT延長症候群などの不整脈の原因になります。
心臓では複数種類のイオンチャネルがさまざまなタイミングで開閉して心臓の活動電位を制御しています。その中でも、KCNQ1/KCNE1チャネルによるIKs電流は活動電位の比較的遅いタイミングで流れます。遺伝子の異常などによりIKs電流がなくなってしまうと、活動電位の延長が起き(赤い点線)、QT延長症候群などの不整脈の原因になります。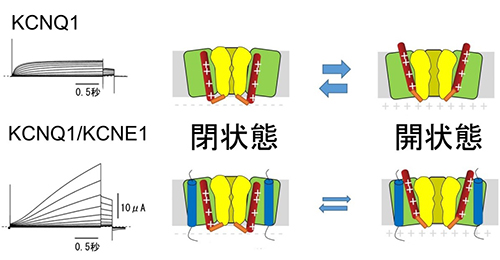 一般に膜電位依存性イオンチャネルにおいては、細胞内の電位が+に転じること(脱分極)によって、正電荷を持つ4番目の膜貫通領域(S4、図中赤い棒)が細胞外に向かって動き、イオンを透過するためのゲートが開きます。KCNE1が結合することにより、KCNQ1チャネルの開閉速度は遅くなり、開きにくい性質に変わります。
一般に膜電位依存性イオンチャネルにおいては、細胞内の電位が+に転じること(脱分極)によって、正電荷を持つ4番目の膜貫通領域(S4、図中赤い棒)が細胞外に向かって動き、イオンを透過するためのゲートが開きます。KCNE1が結合することにより、KCNQ1チャネルの開閉速度は遅くなり、開きにくい性質に変わります。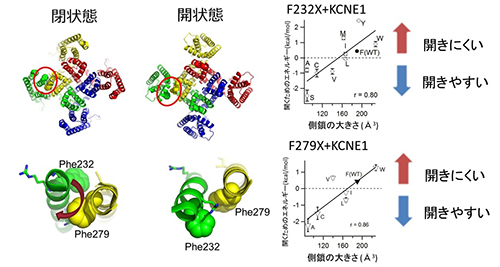 KCNQ1/KCNE1チャネルにおいて、Phe232(F232)とPhe279(F279)をさまざまなアミノ酸に変異させると、アミノ酸側鎖が大きいほど、開くために高い電位が必要になります。
KCNQ1/KCNE1チャネルにおいて、Phe232(F232)とPhe279(F279)をさまざまなアミノ酸に変異させると、アミノ酸側鎖が大きいほど、開くために高い電位が必要になります。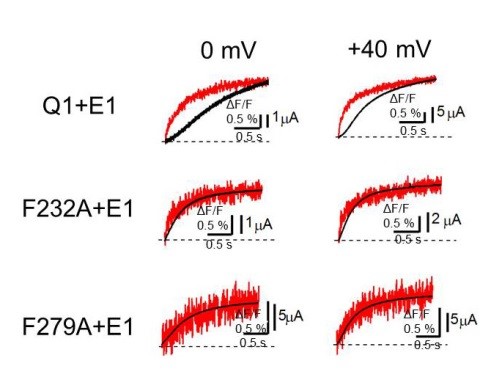 電位センサードメインの動きを示す蛍光強度 (赤)と電流(黒)を同時測定すると、KCNQ1/KCNE1チャネル(Q1+E1)では電位センサーが動いたあと電流が流れるまでに遅延が生じますが、Phe232あるいはPhe279を小さいアラニン残基に変異させると(F232A/F279A)、その遅延がほぼ見られなくなります。
電位センサードメインの動きを示す蛍光強度 (赤)と電流(黒)を同時測定すると、KCNQ1/KCNE1チャネル(Q1+E1)では電位センサーが動いたあと電流が流れるまでに遅延が生じますが、Phe232あるいはPhe279を小さいアラニン残基に変異させると(F232A/F279A)、その遅延がほぼ見られなくなります。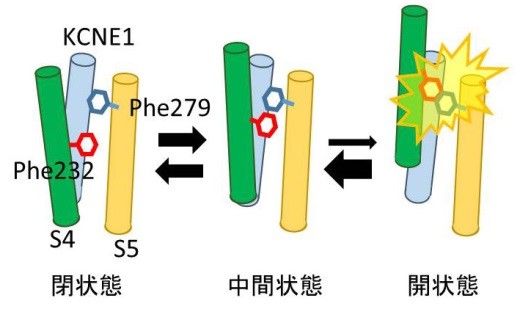 KCNQ1/KCNE1チャネルが閉状態から中間状態を経て開状態に至る際、4番目の膜貫通領域(S4)上のPhe232と5番目の膜貫通領域(S5)上のPhe279がぶつかることで、開状態が不安定化してチャネルが開きにくくなっていると考えられます。
KCNQ1/KCNE1チャネルが閉状態から中間状態を経て開状態に至る際、4番目の膜貫通領域(S4)上のPhe232と5番目の膜貫通領域(S5)上のPhe279がぶつかることで、開状態が不安定化してチャネルが開きにくくなっていると考えられます。
 脳活動を測定している状態で実験参加者は、上図にある動作うち1つを行い、その直後に他者が行う動作を観察しました。他者の動作は自分の動作と同じ場合(真似をされる条件)と異なる場合(真似をされない条件)があります。
脳活動を測定している状態で実験参加者は、上図にある動作うち1つを行い、その直後に他者が行う動作を観察しました。他者の動作は自分の動作と同じ場合(真似をされる条件)と異なる場合(真似をされない条件)があります。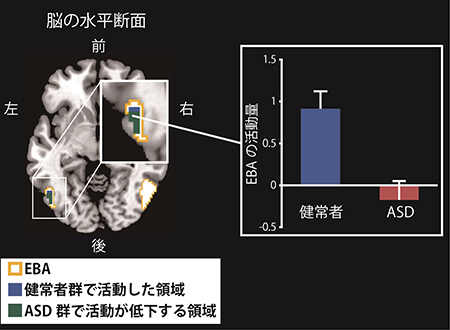 左図は、真似をされていないときに比べて真似をされたときに強く活動した領域を示しています。健常群ではEBA(黄色枠)の一部が活動しましたが(脳断面の青色の部分)、ASD群では活動が低下していました(脳断面の緑色の部分)。右図は、その領域の活動量を棒グラフで表しています。青色の健常群と赤色のASD群で、EBA領域の活動量に差があることが分かりました。
左図は、真似をされていないときに比べて真似をされたときに強く活動した領域を示しています。健常群ではEBA(黄色枠)の一部が活動しましたが(脳断面の青色の部分)、ASD群では活動が低下していました(脳断面の緑色の部分)。右図は、その領域の活動量を棒グラフで表しています。青色の健常群と赤色のASD群で、EBA領域の活動量に差があることが分かりました。

 実験参加者はMRIスキャナー内で模型に触れて、手を触った場合はその動作を、急須や車を触った場合はその種類を識別しました(触覚課題)。さらに晴眼者は目のみを使う識別も行いました(視覚課題)。急須や車に比べて手の識別で強く活動する脳部位を、Action Observation Network (AON)として特定しました。
実験参加者はMRIスキャナー内で模型に触れて、手を触った場合はその動作を、急須や車を触った場合はその種類を識別しました(触覚課題)。さらに晴眼者は目のみを使う識別も行いました(視覚課題)。急須や車に比べて手の識別で強く活動する脳部位を、Action Observation Network (AON)として特定しました。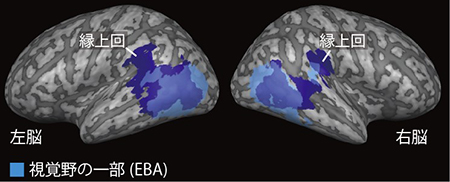 藍色の領域は、晴眼者が急須や車に比べて手の動作を識別した時に強く活動した脳部位を示しています。この脳部位は触って識別する課題(触覚課題)でも見て識別する課題(視覚課題)でも、手の動作に対して強く活動しました。水色の部分は、視覚から得られる身体の情報を専ら処理する脳部位(EBA)を示しています。活動をわかりやすく図示するために大脳皮質を膨らませて示しています。濃い灰色は脳溝を示し、薄い灰色は脳回を示しています。
藍色の領域は、晴眼者が急須や車に比べて手の動作を識別した時に強く活動した脳部位を示しています。この脳部位は触って識別する課題(触覚課題)でも見て識別する課題(視覚課題)でも、手の動作に対して強く活動しました。水色の部分は、視覚から得られる身体の情報を専ら処理する脳部位(EBA)を示しています。活動をわかりやすく図示するために大脳皮質を膨らませて示しています。濃い灰色は脳溝を示し、薄い灰色は脳回を示しています。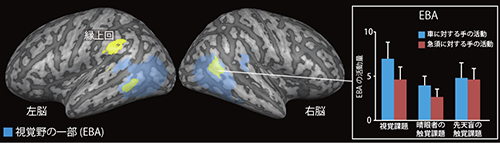 黄色の領域は、先天盲と晴眼者で手の動作の認識時に共通して活動した脳部位を示しています。視覚経験に関係なく縁上回とEBAの一部が活動していることが分かります。水色の部分は図2と同じように、視覚から得られる身体の情報を専ら処理する脳部位(EBA)を示しています。濃い灰色は脳溝を示し、薄い灰色は脳回を示しています。
黄色の領域は、先天盲と晴眼者で手の動作の認識時に共通して活動した脳部位を示しています。視覚経験に関係なく縁上回とEBAの一部が活動していることが分かります。水色の部分は図2と同じように、視覚から得られる身体の情報を専ら処理する脳部位(EBA)を示しています。濃い灰色は脳溝を示し、薄い灰色は脳回を示しています。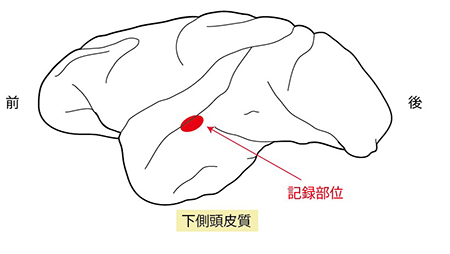 ニホンザルの高次視覚野である下側頭皮質の個々の神経細胞の働きを、極細電極を用いて調べました。
ニホンザルの高次視覚野である下側頭皮質の個々の神経細胞の働きを、極細電極を用いて調べました。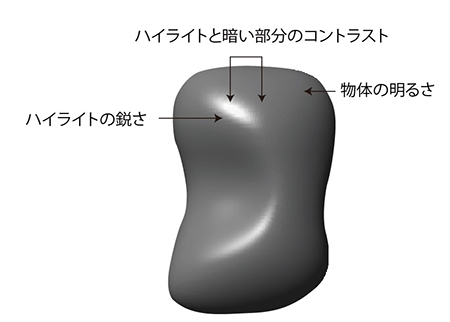 光沢を知覚する際には、ハイライトのコントラスト(c)、ハイライトの鋭さ ( d )、物体の明るさ( pd ) といった指標を使っていると考えられています。
光沢を知覚する際には、ハイライトのコントラスト(c)、ハイライトの鋭さ ( d )、物体の明るさ( pd ) といった指標を使っていると考えられています。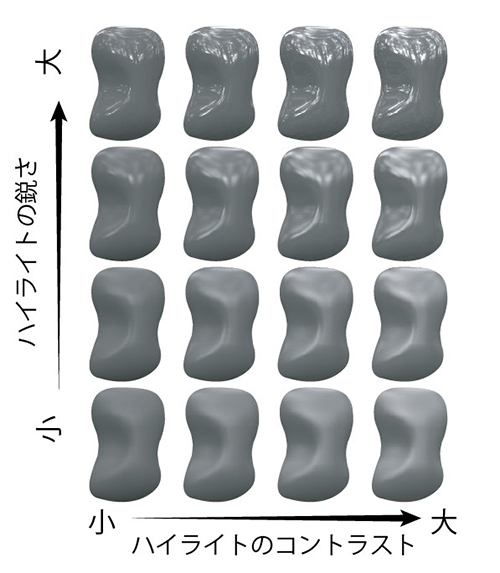 実際に、脳内でどのように光沢の情報が処理されているかを調べるため、ハイライトのコントラスト(c)と鋭さ(d)をそれぞれ4段階変化させ、明るさ( pd ) も3段階変化させた刺激を作成して、それぞれの刺激に対する神経細胞の応答を調べました。
実際に、脳内でどのように光沢の情報が処理されているかを調べるため、ハイライトのコントラスト(c)と鋭さ(d)をそれぞれ4段階変化させ、明るさ( pd ) も3段階変化させた刺激を作成して、それぞれの刺激に対する神経細胞の応答を調べました。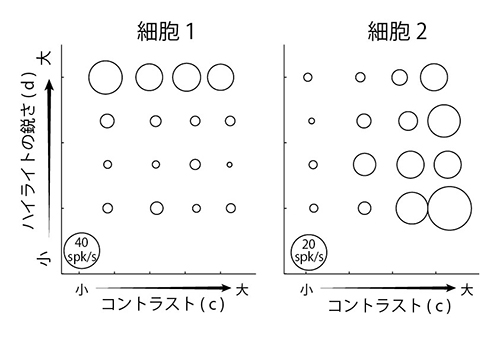 ハイライトの鋭さに応答した細胞(左)とハイライトのコントラストに反応した細胞(右)の例を示します。円の配置は、図3に対応しており、円の大きさはそれぞれの画像刺激に対するそれぞれの神経細胞の応答の強さを示しています。
ハイライトの鋭さに応答した細胞(左)とハイライトのコントラストに反応した細胞(右)の例を示します。円の配置は、図3に対応しており、円の大きさはそれぞれの画像刺激に対するそれぞれの神経細胞の応答の強さを示しています。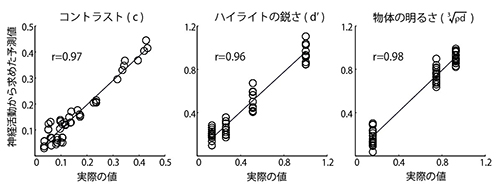 記録した神経細胞の集団の応答をもとに、光沢知覚に関わる画像の指標が正確に再現できました。このことから、今回記録した下側頭皮質の神経細胞は光沢知覚と密接に関わる3種類の指標(コントラスト、鋭さ、明るさ )に関する情報を表現していると考えられます。
記録した神経細胞の集団の応答をもとに、光沢知覚に関わる画像の指標が正確に再現できました。このことから、今回記録した下側頭皮質の神経細胞は光沢知覚と密接に関わる3種類の指標(コントラスト、鋭さ、明るさ )に関する情報を表現していると考えられます。






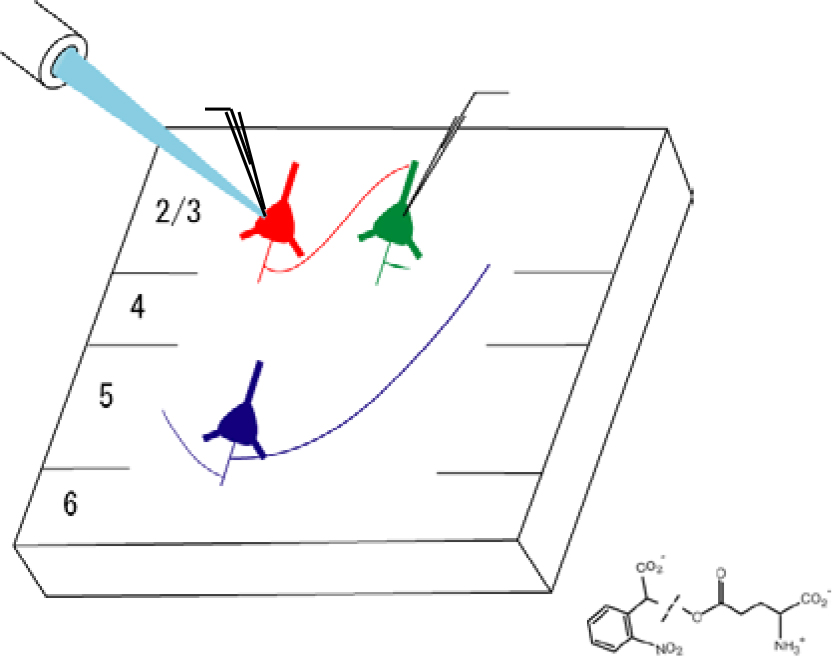
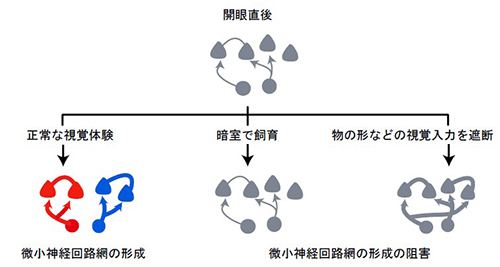 生後の視覚体験に依存した一次視覚野の微小神経回路網の形成を示しています。生後正常な視覚経験を経た場合、入力される多様な視覚情報を混同することなく処理を行うための、独立した微小回路網が形成されています。対して暗室で飼育することで全ての視覚情報を遮断した場合では、開眼直後の未成熟な一次視覚野と同様、微小神経回路網は存在せず、また物の形などの視覚入力を遮断した場合では、独立した微小神経回路網の形成が阻害されました。この微小神経回路網が正常に形成されないことが、認知能力低下の一要因となっていると考えられます。
生後の視覚体験に依存した一次視覚野の微小神経回路網の形成を示しています。生後正常な視覚経験を経た場合、入力される多様な視覚情報を混同することなく処理を行うための、独立した微小回路網が形成されています。対して暗室で飼育することで全ての視覚情報を遮断した場合では、開眼直後の未成熟な一次視覚野と同様、微小神経回路網は存在せず、また物の形などの視覚入力を遮断した場合では、独立した微小神経回路網の形成が阻害されました。この微小神経回路網が正常に形成されないことが、認知能力低下の一要因となっていると考えられます。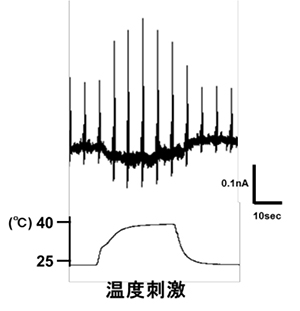
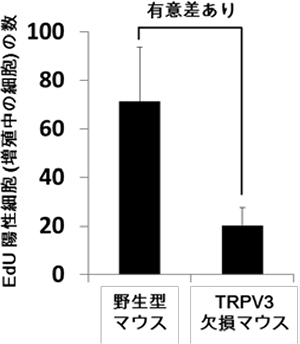
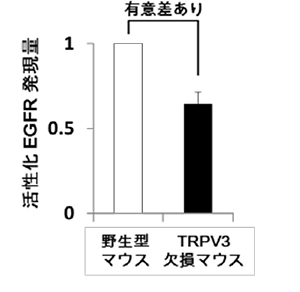
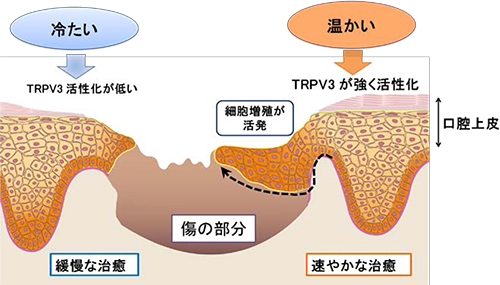

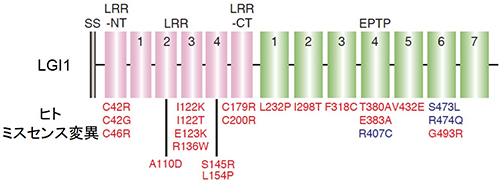 てんかん家系でみられるLGI1変異の多くは分泌不全型(赤色)でしたが、分泌型の変異(青色)も3つ見出しました。
てんかん家系でみられるLGI1変異の多くは分泌不全型(赤色)でしたが、分泌型の変異(青色)も3つ見出しました。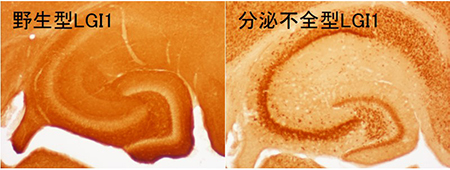 野生型(正常な)LGI1タンパク質は脳内でシナプスが存在する分子層に局在しますが(左)、てんかん家系で見られる分泌不全型LGI1は、タンパク質の構造異常が原因で、細胞体に貯留しシナプスに輸送されずに分解されてしまいます。その結果、LGI1¬–ADAM22によるシナプス伝達の制御が破綻し、てんかん病態が惹起されます。
野生型(正常な)LGI1タンパク質は脳内でシナプスが存在する分子層に局在しますが(左)、てんかん家系で見られる分泌不全型LGI1は、タンパク質の構造異常が原因で、細胞体に貯留しシナプスに輸送されずに分解されてしまいます。その結果、LGI1¬–ADAM22によるシナプス伝達の制御が破綻し、てんかん病態が惹起されます。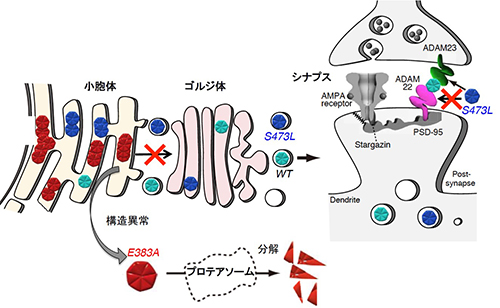 分泌不全型LGI1 (赤色)は小胞体内で異常タンパク質として認識され、速やかに分解されます。一方、分泌型変異LGI1(濃青色)はシナプスで分泌されますが、受容体であるADAM22との結合能が欠損していました。
分泌不全型LGI1 (赤色)は小胞体内で異常タンパク質として認識され、速やかに分解されます。一方、分泌型変異LGI1(濃青色)はシナプスで分泌されますが、受容体であるADAM22との結合能が欠損していました。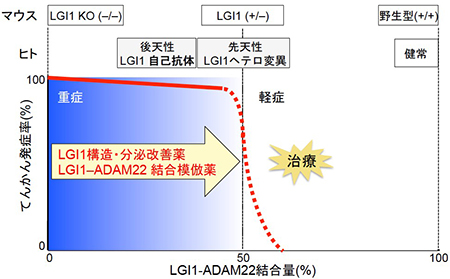 LGI1ノックアウト(KO;–/–)マウスは生後3週間以内に致死性てんかんを必発します。また、LGI1ヘテロマウス(+/–)や今回樹立したLGI1変異マウスでは、正常なLGI1の量が半減し、てんかん感受性が亢進しています。一方、ヒトでは先天性の遺伝子変異だけでなく、後天性(主に中高年者)にLGI1自己抗体が生じ、結果としてLGI1–ADAM22結合量が減少した場合でも“てんかん病態”が惹起されます。すなわち、LGI1–ADAM22結合量がある閾値を下回ると“てんかん病態”が生じることが分かりました。したがって、化学シャペロンを代表とする“LGI1構造・分泌改善薬”や“LGI1–ADAM22結合模倣薬”はLGI1の抗てんかん作用を賦活(活性化)することで、新規の抗てんかん薬となることが期待されます。
LGI1ノックアウト(KO;–/–)マウスは生後3週間以内に致死性てんかんを必発します。また、LGI1ヘテロマウス(+/–)や今回樹立したLGI1変異マウスでは、正常なLGI1の量が半減し、てんかん感受性が亢進しています。一方、ヒトでは先天性の遺伝子変異だけでなく、後天性(主に中高年者)にLGI1自己抗体が生じ、結果としてLGI1–ADAM22結合量が減少した場合でも“てんかん病態”が惹起されます。すなわち、LGI1–ADAM22結合量がある閾値を下回ると“てんかん病態”が生じることが分かりました。したがって、化学シャペロンを代表とする“LGI1構造・分泌改善薬”や“LGI1–ADAM22結合模倣薬”はLGI1の抗てんかん作用を賦活(活性化)することで、新規の抗てんかん薬となることが期待されます。 実験には8つの素材を撮影した写真から採取した一万枚以上のテクスチャを用いました。(図はその中の一例です)
実験には8つの素材を撮影した写真から採取した一万枚以上のテクスチャを用いました。(図はその中の一例です)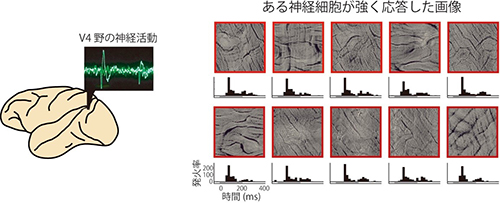 左図:サルがテクスチャ画像を見ている時のV4野の神経細胞の応答を記録しました。
左図:サルがテクスチャ画像を見ている時のV4野の神経細胞の応答を記録しました。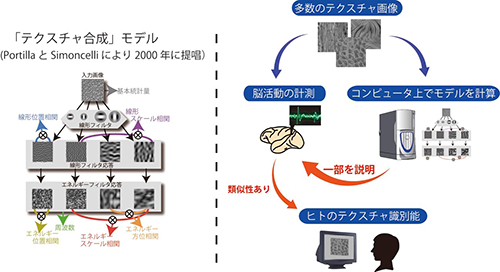 左図:V4野の細胞応答を説明するのに用いた「テクスチャ合成」モデル。このモデルでは一枚のテクスチャ画像から、「フィルタ処理」や「相関計算」といった複雑な演算により、多数の特徴量を算出します。
左図:V4野の細胞応答を説明するのに用いた「テクスチャ合成」モデル。このモデルでは一枚のテクスチャ画像から、「フィルタ処理」や「相関計算」といった複雑な演算により、多数の特徴量を算出します。