ポイント
▼統合失調症は総人口の約1%で発症し、遺伝要因と環境要因の両方が発症に関与。
▼ ヒトの統合失調症に似たモデルマウスを作成。炎症を抑えることで症状の一部が改善。
▼統合失調症の新しい予防・診断・治療法の開発と創薬に期待。
JST 課題達成型基礎研究の一環として、藤田保健衛生大学 総合医科学研究所の宮川 剛 教授、自然科学研究機構 生理学研究所の高雄 啓三 特任准教授らは、遺伝子操作により脳内で軽度の慢性炎症を起こさせたマウスは、脳の一部が未成熟な状態になっており、その結果、作業記憶注1)の低下や巣作り行動の障害が引き起こされていることを明らかにしました。
本研究グループは、行動異常を網羅的に調べる「網羅的行動テストバッテリー注2)」を用い、約10年にわたり精神疾患のモデルマウスの探索を行っています。これまでに160系統以上を解析した結果、Schnurri-2注3)遺伝子欠損(Shn-2 KO)マウスが作業記憶と呼ばれるタイプの記憶や、社会的行動の異常など、統合失調症注4)患者で見られる症状(主として認知障害や陰性症状)とそっくりな行動異常を示していることを突き止めました。このマウスの脳を解析したところ、遺伝子発現パターンが統合失調症患者の死後脳と酷似していたほか、パルバルブミン注5)陽性細胞数の減少や脳波の異常など統合失調症患者の脳で報告されている特徴の多くを持っていました。さらに、Shn-2 KOマウスの脳で慢性的で軽度な炎症が起こっていること、脳の一部(海馬歯状回)が未成熟な状態にあることを発見しました。炎症を抑えることにより、このマウスの海馬歯状回の成熟状態が改善し、さらに行動異常のうち作業記憶の障害と巣作り行動の障害が改善されることが明らかになりました。
このマウスの脳は統合失調症患者の脳と特徴が極めてよく似ており、このマウスをモデルとして活用することで、統合失調症の病因・病態の理解が飛躍的に進むと考えられます。今後、抗炎症作用を持つ物質と既存の抗精神病薬とを組み合わせた投与の効果をこの統合失調症モデルマウスで検討し、効果が見られた方法で実際の患者の症状が改善するかどうかを調べることにより、統合失調症の新たな治療法の開発が進むと期待されます。
本研究成果は、日本医科大学、理化学研究所など12機関の共同研究により得られ、2013年2月6日(米国東部時間)に米国神経精神薬理学会誌「Neuropsychopharmacology」のオンライン版で公開されます。 |
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
研究領域:「精神・神経疾患の分子病態理解に基づく診断・治療へ向けた新技術の創出」
(研究総括:樋口 輝彦 (独)国立精神・神経センター 総長)
研究課題名:「マウスを活用した精神疾患の中間表現型の解明」
研究代表者:宮川 剛(藤田保健衛生大学 総合医科学研究所 教授)
研究期間:平成19年10月~平成25年3月
JSTはこの領域で、少子化・高齢化・ストレス社会を迎えた日本において社会的要請の強い認知・情動などをはじめとする高次脳機能の障害による精神・神経疾患に対して、脳科学の基礎的な知見を活用し、予防・診断・治療法などで新技術の創出を目標にしています。上記研究課題では、精神疾患モデルマウスの脳について各種先端技術を活用した網羅的・多角的な解析を行い、生理学的、生化学的、形態学的特徴の抽出を進め、さらに、これらのデータを人間の解析に応用することによって、精神疾患における本質的な脳内中間表現型の解明を目指します。
研究の背景と経緯
統合失調症は、あらゆる人種や地域において、総人口の約1%で発症し、十分な予防・治療法が確立されていない深刻な精神疾患です。統合失調症の原因遺伝子探索のため、大規模なゲノムワイド関連解析注6)が近年行われ、統合失調症は単独の遺伝子変異で引き起こされることはごくまれであり、多くの場合は複数の小さい効果を持つ遺伝子多型による遺伝的要因とさまざまな環境要因の組み合わせによって発症すると考えられるようになりました。複数の信頼性の高い大規模解析により、主要組織適合遺伝子複合体(MHC)という免疫にかかわる遺伝子情報が多く含まれる領域で統合失調症に関連する遺伝子多型が多数同定されており、MHC領域と統合失調症との関係が注目されています。
遺伝子改変マウスは、現在の医学生物学研究で欠かせない実験動物になっており、精神疾患研究においても例外ではありません。藤田保健衛生大学 総合医科学研究所の宮川 剛 教授と自然科学研究機構 生理学研究所の高雄 啓三 特任准教授らの研究グループは、これまでに、多くの遺伝子改変マウスの系統について、「網羅的行動テストバッテリー」を用いて行動を調べることで、個体レベルでの遺伝子の異常がどのように行動の異常に結びつくかを調べてきました。2003年に本研究グループが発足して以来、多数の国内外の研究室との共同研究で160以上の異なる系統のマウスに対して一通りの網羅的行動テストバッテリーを行っています。Schnurri-2欠損(Shn-2 KO)マウスは、これらの中でひときわ顕著な行動異常を示す系統として同定されたものです。Shn-2は先述した統合失調症に関連するという報告のあるMHC領域に結合する分子として当初発見されたもので、MHC領域にある遺伝子の発現制御にかかわっていると考えられています。
研究の内容
今回作成したShn-2 KOマウスは、作業記憶の低下や社会的行動の異常などの、統合失調症と非常によく似た行動異常のパターンを示しました。このマウスの脳を、分子生物学的、神経解剖学的、神経生理学的な手法を用いて解析した結果、Shn-2 KO マウスの脳は統合失調症患者の脳で報告されている特徴を極めて高い類似度で備えていることが発見されました。さらに、このマウスの脳では軽度な慢性炎症が起こっていることが分かりました。気分の調節や学習・記憶に重要であることが知られる海馬歯状回の神経細胞を調べたところ、発達期に一度は成熟しかけていた神経細胞が、マウスが成育するに従って再び未成熟な細胞の特徴を持つようになり(脱成熟)、歯状回全体がいわば未成熟な状態(未成熟歯状回注7))でした。また、抗炎症作用のある薬物を投与することによって海馬歯状回の神経細胞の成熟状態が改善し、それと同時に作業記憶障害や巣作り行動の障害など行動異常の一部が改善されることも明らかになりました。
以下、研究の詳細を解説します。
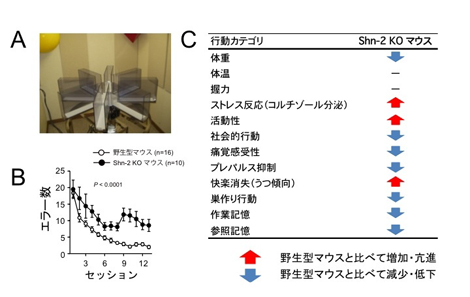
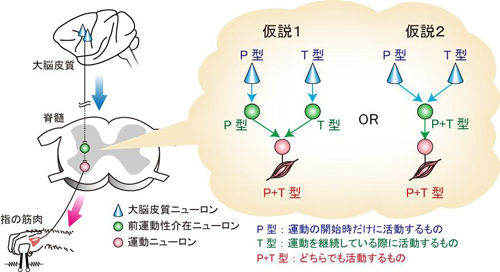
1.Shn-2 KOマウスでは野生型マウスに比べて作業記憶が顕著に悪くなっており、そのほかにプレパルス抑制注8)の障害、社会的行動の低下、巣作り行動の障害、快楽消失など統合失調症に関連する多くの行動異常を示すことが、網羅的行動テストバッテリーによる解析で明らかになりました(図1)。このうちプレパルス抑制の障害は、統合失調症の治療薬として使われているハロペリドールを投与することによって改善されています。これらの結果により、このマウスで見られた一連の行動異常は統合失調症患者で見られる認知障害や陰性症状などに相当するものと考えられます。すなわち、行動レベルで統合失調症患者にそっくりなマウスを同定することができました。
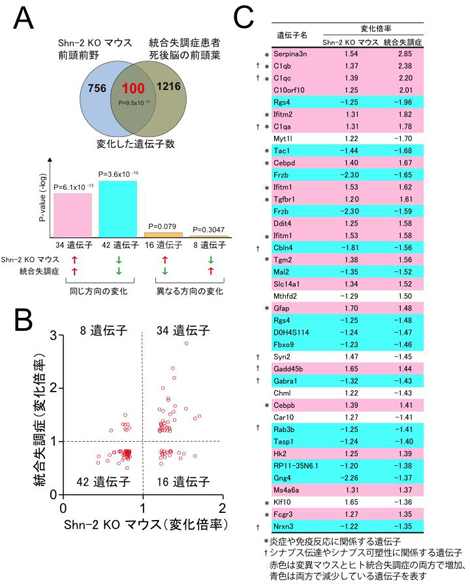
2.このShn-2 KOマウスの前頭皮質の遺伝子発現変化をジーンチップ注9)で調べ、遺伝子の発現パターンをバイオインフォマティクス的手法で解析したところ、Shn-2 KOマウスの脳で発現量が変化している遺伝子の多くは統合失調症患者の死後脳(前頭葉)でもほぼ同様に変化していました。つまり、Shn-2 KOマウスの脳と統合失調患者の死後脳の遺伝子発現パターンの間には驚くべき類似性があるということが分かりました(図2)。
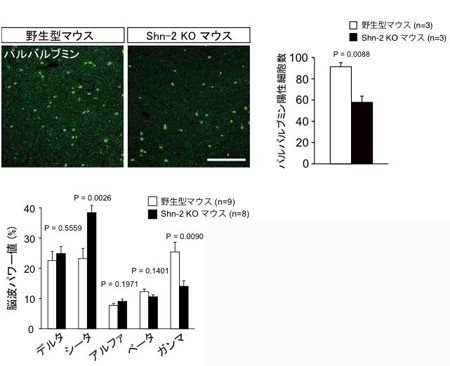
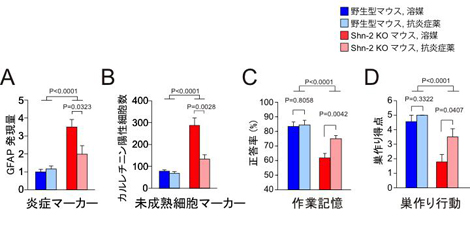
3.さらにShn-2 KOマウスの脳を調べたところ、パルバルブミン陽性細胞の減少、GAD67注10)の発現低下、大脳皮質の薄化、脳波のうちガンマ波の低下など、統合失調症患者の脳で報告されている特徴が多く見られました(図3)。Shn-2 KOマウスは、脳の特徴についても統合失調症患者とそっくりでした。
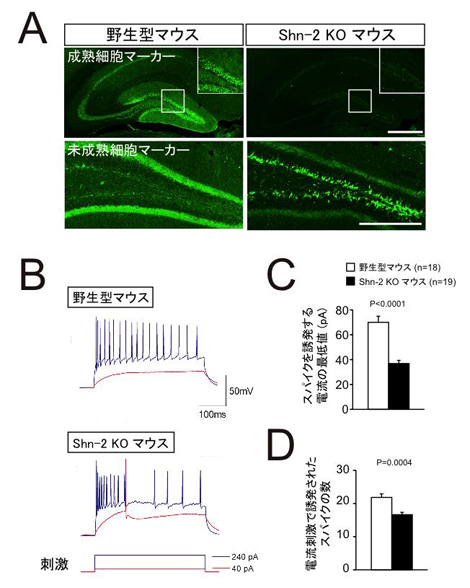
4.Shn-2 KOマウスの海馬歯状回の神経細胞は、発達期にはいったん成熟細胞マーカーであるカルビンジン注11)を発現しているにもかかわらず、その後マウスが成育するに従ってほとんど発現しなくなってしまい(図4)、逆に未成熟細胞のマーカーであるカルレチニン注12)の発現を増加させており、電気生理学的な性質も未成熟な神経細胞に似ていることが明らかになりました。つまり、このマウスでは、発達期に一度成熟しかけた神経細胞が成育に伴って脱成熟しており、成体であるにもかかわらず歯状回全体がいわば未成熟な状態(未成熟歯状回)でした。これは統合失調症の発症が青年期以降であることと一致しています。また、統合失調症患者の死後脳で海馬の歯状回が未成熟な状態にあることは本研究グループの別の研究によって明らかにされています(Walton et al., Transl Psych, 2012)。
5.Shn-2 KOマウスの脳では、神経炎症の特徴の1つであるアストログリア細胞注13)の活性化が顕著でした(図5)。また、このマウスの脳で発現が変化している遺伝子群と、炎症を引き起こす典型的な状態で発現が変化する遺伝子群には、高い共通性が見られました(図5)。さらに、Shn-2 KOマウスの脳におけるそれらの遺伝子群の変化は、典型的な炎症で変化する場合と比較すると小さく(図5)、このマウスの脳では、慢性的で軽度な炎症が起こっていると考えられます。
6.そこで、抗炎症作用を持つ薬物であるイブプロフェンとロリプラムをShn-2 KOマウスに3週間にわたって投与したところ、海馬歯状回で増加していた未成熟細胞マーカーのカルレチニンの発現が低下し、正常な状態に近付きました(図6)。それと同時に、このマウスで見られた作業記憶の障害と巣作り行動の異常も改善しました(図6)。
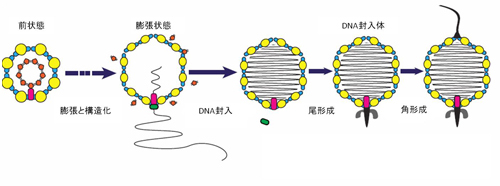
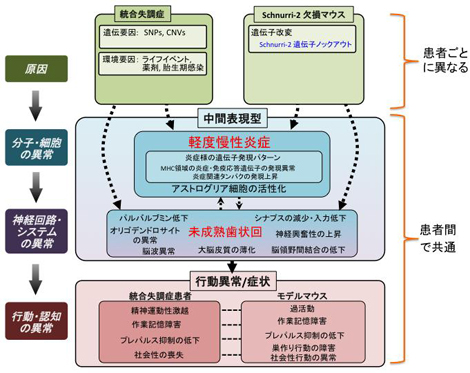
以上より、Shn-2 KOマウスでは、遺伝的な要因によって脳内に慢性的で軽度な炎症が生じ、それが海馬歯状回の脱成熟を引き起こし、その結果、統合失調症に似た行動異常のうち作業記憶の障害や巣作り行動の異常が生じているのではないかと考えられます。炎症の起こる原因はさまざまですが、ヒトでも何らかの遺伝・環境要因により脳内に慢性的で軽度な炎症が起これば、海馬歯状回の脱成熟などのさまざまな現象が脳で生じ、その結果として統合失調症が発症するというモデルが想定され(図7)、このモデルに基づいた新たな予防・診断・治療法の開発が期待されます。
今後の展開
統合失調症は慢性化する症例が多く、治療効果は十分とは言えません。効果的な治療法の研究開発が重要ですが、そのためにはヒト疾患によく対応したモデル動物が必要となります。Shn-2 KOマウスは、行動および脳の特徴において統合失調症患者と極めてよく似ており、これまでにない統合失調症モデルマウスです。このマウスを活用することにより、統合失調症に対する新しい予防・診断・治療法の開発や創薬につながることが期待できます。
今回、Shn-2 KOマウスへの抗炎症作用を持つ薬物の投与によって、神経の炎症の指標であるアストログリア細胞の活性化が抑まり、歯状回の神経細胞で増加していた未成熟細胞のマーカーが低下し、作業記憶の障害と巣作り行動の異常が改善されました。一方で、抗炎症薬の投与は、パルブルブミン陽性細胞数の低下や、GAD67の発現低下については改善しませんでした。行動レベルでは、プレパルス抑制の低下や活動性の増加などには抗炎症薬投与の効果は見られませんでした。つまり、統合失調症で見られるさまざまな症状には、脳内の慢性炎症や未成熟歯状回が関係しているものと、そうでないものに分類できる可能性があります。
これらのことから、統合失調症の予防・治療には既存の抗精神病薬と抗炎症作用のある物質との組み合わせが有効であることが示唆されます。炎症を抑える物質にはイブプロフェンをはじめとしてすでに薬剤として使われているものが多数あるほか、開発中のものも多くあります。また、食物の成分にも炎症を抑える作用のあるものが知られています。こうした物質のうちのどれかが統合失調症の予防・治療に使える可能性が高いと考えられます。
今後、これらの抗炎症作用を持つ物質と既存の抗精神病薬とを組み合わせた投与の効果をこの統合失調症モデルマウスで検討し、マウスで効果的だった組み合わせを用いて実際の統合失調症患者の症状を改善させる試みが可能となります。このような研究を行うことで、この疾患の新たな予防・診断・治療法の開発が進むと見込まれます。
本研究は、JST 戦略的創造研究推進事業 チーム型研究(CREST)の一環として、藤田保健衛生大学、自然科学研究機構 生理学研究所、日本医科大学、理化学研究所、九州大学、久留米大学、岐阜大学、愛知県 心身障害者コロニー発達障害研究所、アステラス製薬株式会社、放射線医学研究所、東京工業大学の11機関の共同研究によって行われました。なお、本研究の一部は、科学研究費補助金による支援を受けて行われました。
参考図
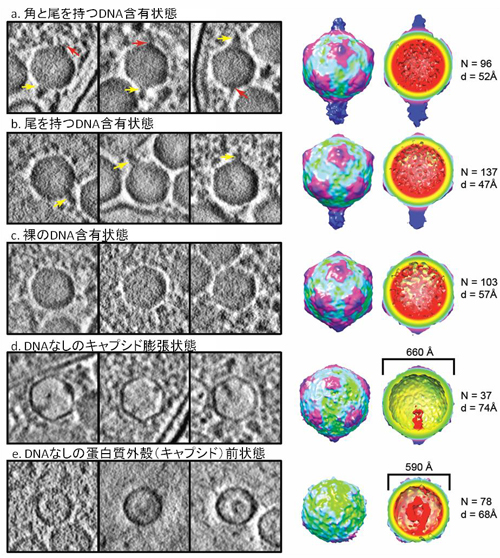
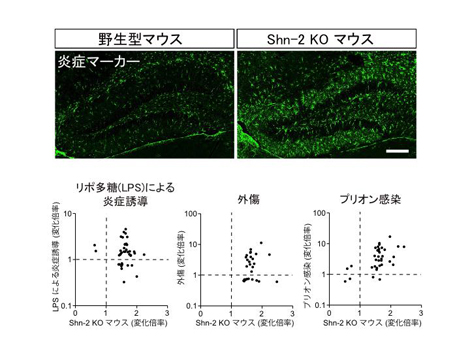
図1 Shn-2 KO マウスで見られた統合失調症に似た行動異常
![miyakawapress-1.jpg]()
Shn-2 KOマウスは、8方向放射状迷路(A)で調べられる作業記憶が顕著に悪くなっていた(B)ほか、活動性の亢進、社会的行動の低下、プレパルス抑制の障害など統合失調症に似た行動異常のパターンを示しました(C)。
図2 Shn-2 KOマウスの脳と統合失調症患者の死後脳の遺伝子発現パターン
![miyakawapress-2.jpg]()
(A、B)Shn-2 KOマウスの前頭葉における遺伝子発現パターンと、統合失調症患者の死後脳の遺伝子発現パターンを比較したところ、驚くべきことに100もの遺伝子が共通して変動しており、さらにほとんどの遺伝子発現変化の増減の向きが同じでした。
(C)共通して増加している遺伝子には炎症や免疫反応に関係しているものが多く、減少している遺伝子にはシナプス伝達やシナプス可塑性に関係しているものが多くありました。
図3 Shn-2 KOマウスの脳は統合失調症患者の脳の特徴を備えている
![miyakawapress-3.jpg]()
Shn-2 KOマウスの脳の解析を進めたところ、パルバルブミンを発現する細胞数が減っており(上)、皮質の厚みの低下、脳波ガンマ成分の低下(下)など、統合失調症の脳で見られる特徴が多く見られました。
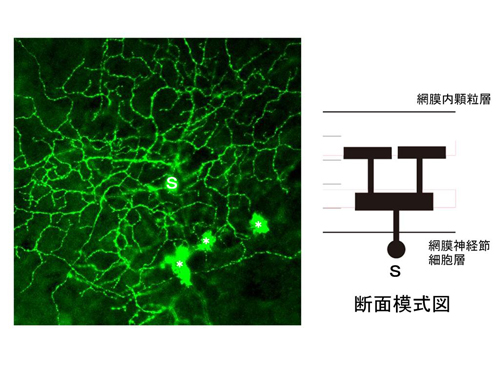
図4 Shn-2 KOマウスの海馬歯状回は未成熟である
![miyakawapress-4.jpg]()
(A)Shn-2 KOマウスの海馬歯状回の神経細胞では成熟細胞に対応する分子マーカーであるカルビンジンの発現が減少(上)、逆に未成熟細胞のマーカーであるカルレチニンが増加していました(下)。
(B)Shn-2 KOマウスの海馬歯状回の神経細胞は、発火しやすく持続しない傾向があり、電流刺激によるスパイク(神経活動電位)の誘発実験において小さい電流で発火するものの(C)、誘発されるスパイク数は少ない(D)など未成熟な神経細胞の特徴を示していました。
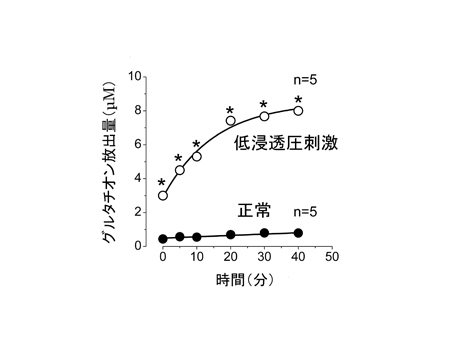
図5 Shn-2 KOマウスの脳では軽度な慢性炎症が起こっている
![miyakawapress-5.jpg]()
Shn-2 KOマウスの脳では、神経炎症の特徴の1つであるアストログリア細胞の活性化が顕著でした(上)。このマウスの脳で発現が変化している遺伝子群は急性の炎症で変化する遺伝子と共通するものが多くあり、両者の間には高い類似性がありました(下)。Shn-2 KOマウスの脳におけるそれらの遺伝子群の変化は炎症で変化する場合と比較すると小さく、このマウスの脳で起こっているのは急性の炎症とは異なり、軽度な慢性炎症であると考えられます。
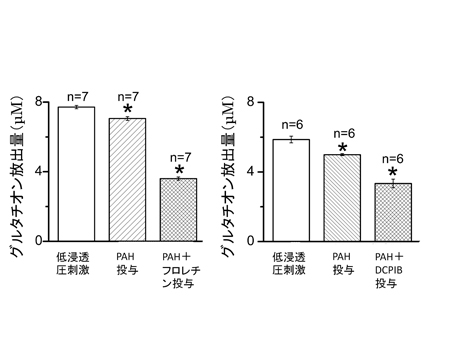
図6 抗炎症作用を持つ薬物の投与で未成熟歯状回および作業記憶障害、巣作り行動の異常が改善される
![miyakawapress-6.jpg]()
抗炎症作用のあるイブプロフェンおよびロリプラムを3週間にわたり投与したところ、Shn-2 KOマウスで、神経の炎症の指標であるアストログリア細胞の活性化が抑まり(A)、海馬歯状回の未成熟神経細胞のマーカーであるカルレチニンの発現が正常レベルに戻り(B)、T字型迷路で計測される作業記憶の障害が改善し(C)、巣作り行動の障害も改善されました(D)。
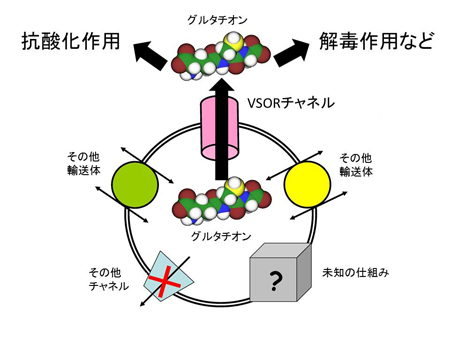
図7 本研究のまとめ
![miyakawapress-7.jpg]()
Shn-2 KOマウスでは、遺伝的な要因によって脳内に慢性的で軽度な炎症が生じ、それが海馬歯状回の脱成熟(未成熟歯状回)を引き起こし、その結果、統合失調症様の行動異常のうち作業記憶の障害や巣作り行動の異常などが生じていることが分かりました。ヒトでは複数の遺伝的要因、環境要因などのユニークな組み合わせで、患者ごとに異なる発症要因が、慢性炎症や歯状回神経細胞の成熟度異常(未成熟歯状回)など、さまざまな脳内の異常を引き起こしている可能性があります。これらは患者間である程度共通しており、統合失調症の中間表現型となります。これらの脳内で起こる異常により、共通したさまざまな行動異常(症状)が導かれると考えられます。
用語解説
注1)作業記憶
状況の変化や作業の進行に応じて、必要な情報の処理と保持を行う記憶機能。長期的・継続的に有効な情報に関する記憶(参照記憶)に対して、その時点で一時的に有効な情報に関する記憶。マウスでは8方向放射状迷路やT字型迷路を用いて作業記憶を調べることができる。
注2)網羅的行動テストバッテリー
遺伝子改変マウスの感覚、運動、情動、睡眠・リズム、注意、学習・記憶、社会的行動などさまざまな行動領域を解析するために用いられている行動テストを組み合わせたもの。効率の良い網羅的な解析を可能としている。
注3)Schnurri-2
ゲノムに結合し、遺伝子の発現を制御するたんぱく質(転写因子)の一種。免疫反応で中心的役割を果たすNF-κBというたんぱく質と競合するため、NF-κBの遺伝子発現制御に影響を与えると考えられている。
注4)統合失調症
陽性症状(妄想や幻覚)、陰性症状(無関心、意欲の低下、社会性の低下)、認知障害が認められる精神疾患。
注5)パルバルブミン
細胞内シグナル伝達に重要なカルシウムイオンに結合するたんぱく質の1つ。海馬歯状回では介在ニューロンと呼ばれる神経細胞に発現している。
注6)ゲノムワイド関連解析
疾患などの患者集団と一般対照集団との間で遺伝情報の違いを検定し、原因となる遺伝子の多様性を見いだすことを、全ゲノム領域で行う方法。
注7)未成熟歯状回
歯状回は記憶をつかさどる海馬の一領域で海馬への情報入力に重要な役割を果たしている。近年、成体においても毎日数千の神経細胞が生まれてくる場所であることが明らかにされた。生まれてきた神経細胞は、刺激を受け活動することにより成長し、1~2ヵ月で「成熟神経細胞」となり海馬の回路に組み込まれ役割を果たすことができる。それまでは「未成熟神経細胞」と呼ばれ、成熟したものとは形状・性質が顕著に異なることが知られている。何らかの原因で歯状回の神経細胞が未成熟な状態になっているものを「未成熟歯状回」と呼んでいる。
注8)プレパルス抑制
強い刺激、例えば大きな音をヒトや動物に突然与えると驚愕反応が引き起こされるが、その刺激の直前に微弱な刺激(小さな音)を提示すると驚愕反応が抑制されることが知られており、この現象をプレパルス抑制(PPI)と呼ぶ。統合失調症患者ではこのPPIが低下していることが報告されている。
注9)ジーンチップ
ガラスや半導体の基板の上にDNAを貼り付けたもので遺伝子がどのように発現しているかを網羅的に調べることができる。
注10)GAD67
グルタミン酸脱炭酸酵素の1つで、この酵素の働きにより、グルタミン酸からγ-アミノ酪酸(GABA)が作られる。
注11)カルビンジン
海馬歯状回では、成熟した顆粒細胞に発現するが、未成熟な顆粒細胞には発現していない。細胞内シグナル伝達に重要なカルシウムイオンに結合するたんぱく質の1つ。
注12)カルレチニン
海馬歯状回では未成熟な顆粒細胞に発現し、成熟した顆粒細胞では発現しない。これもカルシウムイオンに結合するたんぱく質の1つ。
注13)アストログリア細胞
脳や脊髄などの中枢神経系に存在するグリア細胞(神経系における神経細胞ではない細胞の総称)の1つ。炎症により活性化することが知られている。
論文タイトル
“Deficiency of Schnurri-2, an MHC enhancer binding protein, induces mild chronic inflammation in the brain and confers molecular, neuronal, and behavioral phenotypes related to schizophrenia”
(MHCエンハンサー結合たんぱくSchnurri-2の欠損は脳内に軽度な慢性炎症を引き起こし、統合失調症に関連した分子・神経・行動表現型をもたらす)
お問い合わせ先
<研究に関すること>
宮川 剛(ミヤカワ ツヨシ)
藤田保健衛生大学 総合医科学研究所 システム医科学研究部門 教授
〒470-1192 愛知県豊明市沓掛町田楽ヶ窪1-98
Tel:0562-93-9375 Fax:0562-92-5382
E-mail:miyakawa@fujita-hu.ac.jp
<JSTの事業に関すること>
石正 茂(イシマサ シゲル)
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3524 Fax:03-3222-2064
E-mail:crest@jst.go.jp
<報道担当>
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail:jstkoho@jst.go.jp
藤田保健衛生大学 法人本部 総務広報部
〒470-1192 愛知県豊明市沓掛町田楽ヶ窪1番地98
Tel:0562-93-2490 Fax:0562-93-4597
E-mail:kouhou@fujita-hu.ac.jp
自然科学研究機構 生理学研究所 広報展開推進室
准教授 小泉 周(コイズミ アマネ)
〒444-8585 愛知県岡崎市明大寺町字西郷中38
Tel:0564-55-7722 Fax:0564-55-7721
E-mail:public@nips.ac.jp












 画:はやのん理系漫画制作室
画:はやのん理系漫画制作室



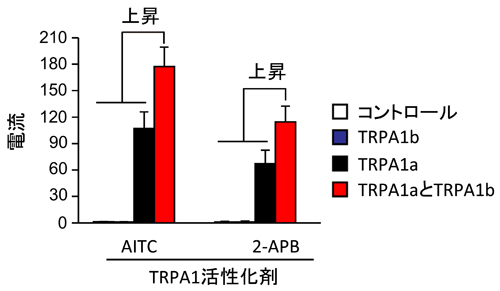 普通のワサビ受容体(TRPA1a)とTRPA1のスプライスバリアント(TRPA1b)をもった培養細胞の2種類のTRPA1活性化剤に対する反応。TRPA1bだけをもった細胞ではTRPA1の応答は見られませんでした。TRPA1aとTRPA1bの両方をもった細胞では、TRPA1aだけをもった細胞より大きな電流応答が観察されました。TRPA1aとTRPA1bの両方があることによってTRPA1機能が増強することがわかりました。これは、痛みが強くなることにつながると考えられます。
普通のワサビ受容体(TRPA1a)とTRPA1のスプライスバリアント(TRPA1b)をもった培養細胞の2種類のTRPA1活性化剤に対する反応。TRPA1bだけをもった細胞ではTRPA1の応答は見られませんでした。TRPA1aとTRPA1bの両方をもった細胞では、TRPA1aだけをもった細胞より大きな電流応答が観察されました。TRPA1aとTRPA1bの両方があることによってTRPA1機能が増強することがわかりました。これは、痛みが強くなることにつながると考えられます。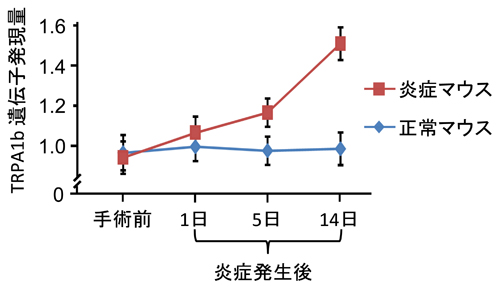 正常マウスではTRPA1b遺伝子(mRNA)は14日まで変化しませんが、CFA(シーエフエー)という起炎物質を足底に注射した炎症性疼痛モデルマウスでは、TRPA1b mRNA量がどんどん増えていくのがわかります。神経障害性モデルでも同様の現象が認められました。
正常マウスではTRPA1b遺伝子(mRNA)は14日まで変化しませんが、CFA(シーエフエー)という起炎物質を足底に注射した炎症性疼痛モデルマウスでは、TRPA1b mRNA量がどんどん増えていくのがわかります。神経障害性モデルでも同様の現象が認められました。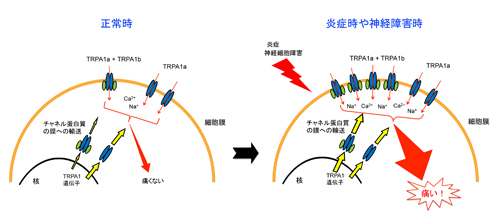 炎症時や神経障害時にはTRPA1bが増えて、感覚神経細胞膜上のTRPA1a/TRPA1b複合体量が増加します。そして、TRPA1の応答性が増強して大きな電流が流れることによって痛み増強につながると考えられます。
炎症時や神経障害時にはTRPA1bが増えて、感覚神経細胞膜上のTRPA1a/TRPA1b複合体量が増加します。そして、TRPA1の応答性が増強して大きな電流が流れることによって痛み増強につながると考えられます。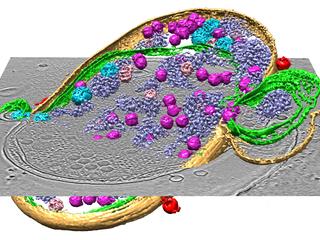 急速凍結法により氷に閉じ込められたシアノバクテリアについて、位相差電子顕微鏡より内部のウイルスを含めたシアノバクテリアの微細立体構造が明らかとなった。(ベイラー医科大のホームページより)
急速凍結法により氷に閉じ込められたシアノバクテリアについて、位相差電子顕微鏡より内部のウイルスを含めたシアノバクテリアの微細立体構造が明らかとなった。(ベイラー医科大のホームページより)