内容
| 心臓をポンプとして動かすためには細胞の電気活動が必須であり、その電気活動はイオンチャネルと呼ばれる膜タンパク質が担っています。イオンチャネルには複数の種類があり、それぞれのタイミングで開閉することで心臓を規則正しく収縮させています。その中の一つKCNQ1は、KCNE1と呼ばれる膜タンパク質とともに働くことで、他のイオンチャネルと比べ非常にゆっくりと開閉することが知られています。このイオンチャネルの機能が損なわれると不整脈などの疾患を引き起こすことから、この開きにくく閉じにくい性質がヒトの心臓機能には不可欠です。今回、自然科学研究機構生理学研究所の中條浩一助教らは、このKCNQ1/KCNE1チャネルの持つ開きにくく閉じにくい性質が、KCNQ1上に存在する二つのフェニルアラニン残基によってもたらされていることを発見しました。フェニルアラニン残基は比較的大きなアミノ酸であり、二つのフェニルアラニン残基が互いに干渉し、KCNQ1/KCNE1チャネルを開きにくくすることがわかりました。本研究結果により、KCNQ1/KCNE1チャネルの動作原理の理解が深まることで、QT延長症候群などの心疾患に対する薬剤開発にも貢献すると期待されます。本研究はNature Communications(6月12日電子版)に掲載されます。 |
KCNQ1は膜電位依存性カリウムチャネルの一種であり、心臓ではKCNE1と呼ばれる膜タンパク質とイオンチャネル (KCNQ1/KCNE1チャネル)を形成して、心臓の「遅い」カリウム電流を担っています。KCNQ1、KCNE1どちらの遺伝子が損なわれてしまってもQT延長症候群などの心疾患を引き起こすことから、この「遅い」イオンチャネルがヒトの心臓の電気的活動に必要不可欠です(図1)。この「遅い」性質を作りだすために、これまでKCNE1の結合がKCNQ1チャネルを開きにくくしていることはわかっていましたが、その分子機構の理解は十分ではありませんでした。
一般的にイオンチャネルは膜電位センサーと考えられる4番目の膜貫通領域(S4セグメント)が細胞外に向かって動くことが引き金となり、イオンを透過するためのゲートが開きます(図2)。今回、研究グループは、アフリカツメガエル卵母細胞をヒトKCNQ1およびヒトKCNE1遺伝子の発現系として用いて実験を行い、KCNQ1のS4セグメント上の232番目のフェニルアラニン残基(Phe232)が、KCNQ1チャネルの活性化時にポアドメイン(カリウムイオンを透過する部位)に存在する別のフェニルアラニン残基(Phe279)とぶつかることで、KCNQ1チャネルを開きにくくしていることを見出しました(図3)。フェニルアラニンは20種類のアミノ酸の中でも比較的大きい側鎖を持つアミノ酸であり、今回発見したフェニルアラニン残基を他のさまざまな大きさのアミノ酸残基に置換したところ、側鎖の大きさとKCNQ1チャネルの開きやすさに相関関係があることがわかりました(図3)。
さらに電位センサー上部に取り付けた蛍光の強度変化によって電位センサードメインの動きを直接測定したところ、KCNQ1/KCNE1チャネルにおいては、電位センサードメインの動きとイオンチャネル活性(電流)の間に大きな遅延があり、この遅延はこれらのフェニルアラニン残基が原因であることも見出しました(図4)。
以上の結果から、これら2つのフェニルアラニン残基がKCNQ1/KCNE1チャネルを開きにくくする分子メカニズムであると結論付けました(図5)。
中條助教は、「今回の研究により、KCNQ1/KCNE1チャネルが開きにくくなる分子メカニズムを明らかにすることができました。今回の知見をもとに、このチャネルの開きやすさを調節するような不整脈治療薬の開発に役立つ可能性があります。」と話しています。

本研究は文部科学省科学研究費補助金の補助を受けて行われました。
今回の発見
1. KCNQ1の2つのフェニルアラニン残基(Phe232, Phe279)が、KCNQ1/KCNE1チャネルが開く際にぶつかることがわかりました。
2. Phe232, Phe279それぞれにおいて、アミノ酸側鎖が大きいほどKCNQ1/KCNE1チャネルが開きにくくなることがわかりました。
3. Phe232, Phe279の存在により電位センサードメインの動きと電流の間の遅延が生じ、これがKCNQ1/KCNE1チャネルを開きにくくしている分子メカニズムであると考えられました。
図1 心臓ではさまざまなタイミングでイオンチャネルが開閉し活動電位を制御する
 心臓では複数種類のイオンチャネルがさまざまなタイミングで開閉して心臓の活動電位を制御しています。その中でも、KCNQ1/KCNE1チャネルによるIKs電流は活動電位の比較的遅いタイミングで流れます。遺伝子の異常などによりIKs電流がなくなってしまうと、活動電位の延長が起き(赤い点線)、QT延長症候群などの不整脈の原因になります。
心臓では複数種類のイオンチャネルがさまざまなタイミングで開閉して心臓の活動電位を制御しています。その中でも、KCNQ1/KCNE1チャネルによるIKs電流は活動電位の比較的遅いタイミングで流れます。遺伝子の異常などによりIKs電流がなくなってしまうと、活動電位の延長が起き(赤い点線)、QT延長症候群などの不整脈の原因になります。
図2 KCNQ1/KCNE1チャネルは遅く開閉するイオンチャネル
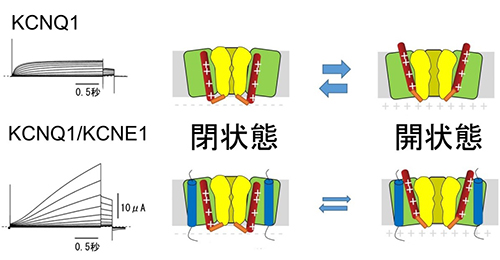 一般に膜電位依存性イオンチャネルにおいては、細胞内の電位が+に転じること(脱分極)によって、正電荷を持つ4番目の膜貫通領域(S4、図中赤い棒)が細胞外に向かって動き、イオンを透過するためのゲートが開きます。KCNE1が結合することにより、KCNQ1チャネルの開閉速度は遅くなり、開きにくい性質に変わります。
一般に膜電位依存性イオンチャネルにおいては、細胞内の電位が+に転じること(脱分極)によって、正電荷を持つ4番目の膜貫通領域(S4、図中赤い棒)が細胞外に向かって動き、イオンを透過するためのゲートが開きます。KCNE1が結合することにより、KCNQ1チャネルの開閉速度は遅くなり、開きにくい性質に変わります。
図3 KCNQ1/KCNE1チャネルの開きやすさはPhe232とPhe279のアミノ酸側鎖の大きさに依存する
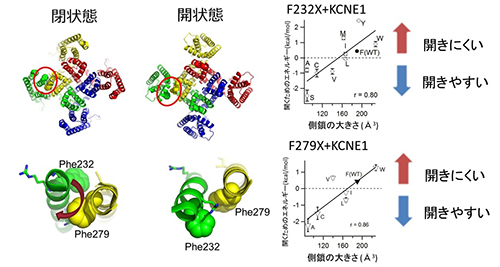 KCNQ1/KCNE1チャネルにおいて、Phe232(F232)とPhe279(F279)をさまざまなアミノ酸に変異させると、アミノ酸側鎖が大きいほど、開くために高い電位が必要になります。
KCNQ1/KCNE1チャネルにおいて、Phe232(F232)とPhe279(F279)をさまざまなアミノ酸に変異させると、アミノ酸側鎖が大きいほど、開くために高い電位が必要になります。
図4 電位センサードメインの動きと電流の間の遅延はPhe232とPhe279によって起こる
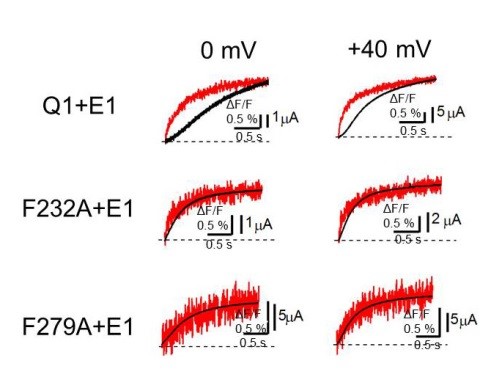 電位センサードメインの動きを示す蛍光強度 (赤)と電流(黒)を同時測定すると、KCNQ1/KCNE1チャネル(Q1+E1)では電位センサーが動いたあと電流が流れるまでに遅延が生じますが、Phe232あるいはPhe279を小さいアラニン残基に変異させると(F232A/F279A)、その遅延がほぼ見られなくなります。
電位センサードメインの動きを示す蛍光強度 (赤)と電流(黒)を同時測定すると、KCNQ1/KCNE1チャネル(Q1+E1)では電位センサーが動いたあと電流が流れるまでに遅延が生じますが、Phe232あるいはPhe279を小さいアラニン残基に変異させると(F232A/F279A)、その遅延がほぼ見られなくなります。
図5 Phe232とPhe279がぶつかることでKCNQ1/KCNE1チャネルが開きにくくなる
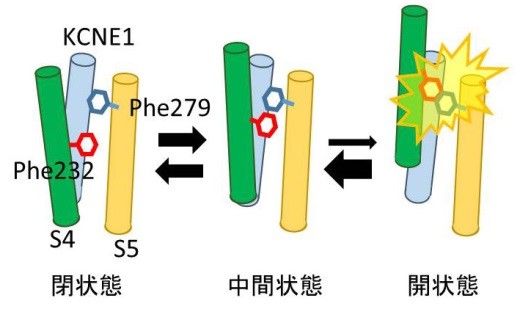 KCNQ1/KCNE1チャネルが閉状態から中間状態を経て開状態に至る際、4番目の膜貫通領域(S4)上のPhe232と5番目の膜貫通領域(S5)上のPhe279がぶつかることで、開状態が不安定化してチャネルが開きにくくなっていると考えられます。
KCNQ1/KCNE1チャネルが閉状態から中間状態を経て開状態に至る際、4番目の膜貫通領域(S4)上のPhe232と5番目の膜貫通領域(S5)上のPhe279がぶつかることで、開状態が不安定化してチャネルが開きにくくなっていると考えられます。
この研究の社会的意義
KCNQ1チャネルの活性化調節機構をターゲットとした新しい不整脈治療薬の開発
KCNQ1、KCNE1ともにQT延長症候群などの不整脈の原因遺伝子です。このイオンチャネル複合体の構造と機能を明らかにすることは、不整脈等の心疾患治療薬を開発する上でも重要です。今回発見はKCNQ1/KCNE1チャネルの動作原理、特に開閉のタイミングについてのメカニズムについての理解を深めるとともに、この知見をもとにした、チャネルの活性を調節するような薬剤あるいは治療法の開発が期待されます。
論文情報
Steric hindrance between S4 and S5 of the KCNQ1/KCNE1 channel hampers pore opening.
Koichi Nakajo and Yoshihiro Kubo.
Nature Communications 5:4100 doi: 10.1038/ncomms5100 (2014).
お問い合わせ先
<研究について>
自然科学研究機構 生理学研究所 神経機能素子研究部門
助教 中條 浩一 (なかじょう こういち)
<広報に関すること>
自然科学研究機構 生理学研究所 研究力強化戦略室
TEL:0564-55-7722、FAX:0564-55-7721
EMAIL:pub-adm@nips.ac.jp